题目内容
14.下列物质中属于有机物的是( )①氰化钠(NaCN) ②丙酮 ③丁炔 ④碳化硅(SiC) ⑤碳酸 ⑥CO ⑦KSCN.
| A. | ①②③④⑦ | B. | ①②③ | C. | ②③ | D. | 全部都是 |
分析 根据有机物和无机物的定义判断,有机物一般是指含碳的化合物,无机物一般是指不含碳的化合物,碳的氧化物、碳酸、碳酸盐、碳化物、氰化物、硫氰化物等性质与无机物相似,常归为无机物.
解答 解:①氰化钠(NaCN) ④碳化硅(SiC) ⑤碳酸 ⑥CO ⑦KSCN虽然是含碳的化合物,但性质与无机物相似,常归为无机物,②丙酮 ③丁炔是含有碳元素的化合物,属于有机物,故选C.
点评 本题主要考查有机物和无机物的定义,理解了两个基本定义的内涵,能注意到区分时除根据是否含碳,还要根据物质的性质,题目较简单.

练习册系列答案
相关题目
4.下列化学方程式或离子方程式正确的是( )
| A. | 用醋酸去除水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 乙醛与新制Cu(OH)2浊液反应:NaOH+CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O | |
| C. | 实验室用液溴和苯在催化剂作用下制溴苯: +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$ | |
| D. | 将CO2通入苯酚钠溶液: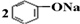 +CO2+H2O→ +CO2+H2O→ +Na2CO3 +Na2CO3 |
5.下列解释中,不正确的是( )
| A. | 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键所致 | |
| B. | 由于NaCl晶体和CsCl晶体中正负离子半径比不相等,所以两晶体中离子的配位数不相等 | |
| C. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| D. | MgO的熔点比MgCl2高主要是因为MgO的晶格能比MgCl2大 |
2.元素周期律的实质是( )
| A. | 相对原子质量逐渐增大 | B. | 核电荷数逐渐增大 | ||
| C. | 核外电子排布呈周期性变化 | D. | 元素化合价呈周期性变化 |
9.某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L.
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
Ⅱ.取少量溶液,加入KSCN溶液无明显变化.
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
Ⅳ. 向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是K+、Fe3+(写离子符号).
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O.
(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为3NO2+H2O═2HNO3+NO
(4)甲同学最终确定原溶液中所含阳离子是Fe2+、Cu2+;,阴离子是Cl-、NO3-、SO42-.(写离子符号)
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为1.6 g.
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl-CO32- NO3- SO42- SiO32- |
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
Ⅱ.取少量溶液,加入KSCN溶液无明显变化.
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
Ⅳ. 向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是K+、Fe3+(写离子符号).
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O.
(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为3NO2+H2O═2HNO3+NO
(4)甲同学最终确定原溶液中所含阳离子是Fe2+、Cu2+;,阴离子是Cl-、NO3-、SO42-.(写离子符号)
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为1.6 g.
19.某有机物的分子式为C5H10O,它能够发生银镜反应和加成反应,若将它与H2加成,所得产物结构简式可能是( )
| A. | (CH3)2CHCH(CH3)OH | B. | CH3(CH2)3CH2OH | C. | CH3CH2C(CH3)2OH | D. | (CH3CH2)2CHOH |
6.将铁和氧化铁的混合物15g,加入150mL稀硫酸中,在标准状况下放出氢气1.68L,同时铁和氧化铁均无剩余.向溶液中滴入硫氰化钾溶液,未见颜色变化.为了中和过量的硫酸,而且使铁完全转化成Fe(OH)2,共消耗3mol•L-1的氢氧化钠溶液200mL,原硫酸溶液的浓度是( )
| A. | 1.5mol•L-1 | B. | 2mol•L-1 | C. | 2.5mol•L-1 | D. | 3mol•L-1 |
3.现有分子式均为C3H6O2的四种有机物A、B、C、D,把它们分别进行下列实验加以鉴别,实验结果如下.已知A、B、C、D中同一碳原子上均不连接两个或两个以上的官能团.
写出A、B、C、D的结构简式:
A:CH3CH2COOH.
B:CH3CH(OH)CHO.
C:HCOOCH2CH3.
D:CH3COOCH3.
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
| A | 发生中和反应 | - | Cu(OH)2溶解 | 产生氢气 |
| B | - | 有银镜 | 产生砖红色沉淀 | 产生氢气 |
| C | 发生水解反应 | 有银镜 | 产生砖红色沉淀 | - |
| D | 发生水解反应 | - | - | - |
A:CH3CH2COOH.
B:CH3CH(OH)CHO.
C:HCOOCH2CH3.
D:CH3COOCH3.
4.下列排列顺序不正确的是( )
| A. | 原子半径:K>Na>S>O | B. | 离子半径:Na+>Mg2+>O2->F- | ||
| C. | 酸性:H2SO4>H3PO4>H2SiO3 | D. | 碱性:KOH>Ca(OH)2>Mg(OH)2 |