题目内容
15.下列化合物中不含离子键的是( )| A. | Na2O | B. | HCl | C. | CaCl2 | D. | Na2CO3 |
分析 活泼金属和活泼金属元素之间易形成离子键,非金属元素之间易形成共价键,碱土金属、碱金属族元素和氧族、卤族元素之间易形成离子键,据此分析解答.
解答 解:A.氧化钠中钠离子和氧离子之间只存在离子键,故A不选;
B.HCl分子中H-Cl原子之间只存在共价键,故B选;
C.氯化钙中钙离子和氯离子之间只存在离子键,故C不选;
D.碳酸钠中钠离子和碳酸根离子之间存在离子键、C-O原子之间存在共价键,故D不选;
故选B.
点评 本题考查化学键,侧重考查基本概念,明确离子键构成条件是解本题关键,知道离子键和共价键的区别,题目难度不大.

练习册系列答案
相关题目
5.下列解释中,不正确的是( )
| A. | 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键所致 | |
| B. | 由于NaCl晶体和CsCl晶体中正负离子半径比不相等,所以两晶体中离子的配位数不相等 | |
| C. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| D. | MgO的熔点比MgCl2高主要是因为MgO的晶格能比MgCl2大 |
6.将铁和氧化铁的混合物15g,加入150mL稀硫酸中,在标准状况下放出氢气1.68L,同时铁和氧化铁均无剩余.向溶液中滴入硫氰化钾溶液,未见颜色变化.为了中和过量的硫酸,而且使铁完全转化成Fe(OH)2,共消耗3mol•L-1的氢氧化钠溶液200mL,原硫酸溶液的浓度是( )
| A. | 1.5mol•L-1 | B. | 2mol•L-1 | C. | 2.5mol•L-1 | D. | 3mol•L-1 |
3.现有分子式均为C3H6O2的四种有机物A、B、C、D,把它们分别进行下列实验加以鉴别,实验结果如下.已知A、B、C、D中同一碳原子上均不连接两个或两个以上的官能团.
写出A、B、C、D的结构简式:
A:CH3CH2COOH.
B:CH3CH(OH)CHO.
C:HCOOCH2CH3.
D:CH3COOCH3.
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
| A | 发生中和反应 | - | Cu(OH)2溶解 | 产生氢气 |
| B | - | 有银镜 | 产生砖红色沉淀 | 产生氢气 |
| C | 发生水解反应 | 有银镜 | 产生砖红色沉淀 | - |
| D | 发生水解反应 | - | - | - |
A:CH3CH2COOH.
B:CH3CH(OH)CHO.
C:HCOOCH2CH3.
D:CH3COOCH3.
10.下列各组分子中,都属于含极性键的非极性分子的是( )
| A. | C2H4 CH4 | B. | CO2 H2S | C. | C60 C2H4 | D. | NH3 HCl |
20.下列说法正确的是( )
| A. | 可用溴水鉴别直馏汽油和裂化汽油 | |
| B. | 煤的液化和气化都是物理变化 | |
| C. | 煤中含有苯及其同系物,所以煤是工业上获得苯的重要来源 | |
| D. | 石油分馏获得的石油气中,含甲烷、乙烷、乙烯等气态烃 |
7.合成结构简式为 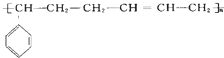 的高聚物,其单体应是( )
的高聚物,其单体应是( )
①苯乙烯 ②丁烯 ③丁二烯 ④丙炔 ⑤苯丙烯.
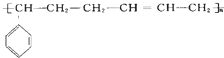 的高聚物,其单体应是( )
的高聚物,其单体应是( )①苯乙烯 ②丁烯 ③丁二烯 ④丙炔 ⑤苯丙烯.
| A. | ② | B. | ④⑤ | C. | ①③ | D. | ③⑤ |
4.下列排列顺序不正确的是( )
| A. | 原子半径:K>Na>S>O | B. | 离子半径:Na+>Mg2+>O2->F- | ||
| C. | 酸性:H2SO4>H3PO4>H2SiO3 | D. | 碱性:KOH>Ca(OH)2>Mg(OH)2 |
5.肼(N2H4)-空气燃料电池是一种环保碱性燃料电池,其电解质溶液是20%-30%的KOH溶液.电池总反应为:N2H4+O2═N2↑+2H2O.下列关于该燃料电池工作时的说法正确的是( )
| A. | 溶液中阴离子物质的量基本不变 | |
| B. | 正极的电极反应式是:O2+4H++4e-═2H2O | |
| C. | 正极的电极反应式是:N2H4+4OH--4e-═H2O+N2↑ | |
| D. | 溶液中阴离子向正极移动 |