题目内容
9.半导体工业用石英砂做原料通过以下三个主要反应生产纯硅:Si(s)(石英砂)+2C(s)═Si(s)(粗硅)+2CO(g)△H=+682.44kJ/mol
Si(s)(粗硅)+2Cl2(s)═SiCl4(g),△H=-657.01kJ/mol
SiCl4(g)+2Mg(s)═2MgCl2(s)+Si(s)(纯硅),△H=-625.63kJ/mol
则生产56.00g纯硅的反应热为( )
| A. | 600.20 kJ•mol-1 | B. | +1200.40 kJ•mol-1 | ||
| C. | -1965.08 kJ•mol-1 | D. | -1200.40 kJ•mol-1 |
分析 由三个热化学方程式可知,生成1mol纯硅,需要热量:+682.44kJ+(-657.01kJ)+(-625.63kJ)=-600.2kJ,计算出56.00g纯硅的物质的量,则可计算出生产56.00g纯硅的总反应热.
解答 解:由三个热化学方程式可知,生成1mol纯硅,需要热量:+682.44kJ+(-657.01kJ)+(-625.63kJ)=-600.2kJ,
n(Si)=56.00g28g/mol=2mol,
则生产56.00g纯硅的总反应热为2mol×(-600.2kJ/mol)=-1200.40kJ,
故选D.
点评 本题考查反应热的计算,题目难度不大,本题注意由已知热化学方程式计算生成1mol纯硅的热量是解答该题的关键,注意把握题给信息.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
19.某有机物的分子式为C5H10O,它能够发生银镜反应和加成反应,若将它与H2加成,所得产物结构简式可能是( )
| A. | (CH3)2CHCH(CH3)OH | B. | CH3(CH2)3CH2OH | C. | CH3CH2C(CH3)2OH | D. | (CH3CH2)2CHOH |
20.下列说法正确的是( )
| A. | 可用溴水鉴别直馏汽油和裂化汽油 | |
| B. | 煤的液化和气化都是物理变化 | |
| C. | 煤中含有苯及其同系物,所以煤是工业上获得苯的重要来源 | |
| D. | 石油分馏获得的石油气中,含甲烷、乙烷、乙烯等气态烃 |
4.下列排列顺序不正确的是( )
| A. | 原子半径:K>Na>S>O | B. | 离子半径:Na+>Mg2+>O2->F- | ||
| C. | 酸性:H2SO4>H3PO4>H2SiO3 | D. | 碱性:KOH>Ca(OH)2>Mg(OH)2 |
14.板蓝根速效感冒冲剂的主要成分之一为“对乙酰氨基酚”,其结构简式为: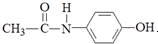 ,有关它的性质描述错误的是( )
,有关它的性质描述错误的是( )
 ,有关它的性质描述错误的是( )
,有关它的性质描述错误的是( )| A. | 它能与NaOH溶液反应 | |
| B. | 其水解产物之一对氨基苯酚(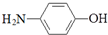 )具有弱酸性、弱碱性和强还原性 )具有弱酸性、弱碱性和强还原性 | |
| C. | 与对硝基乙苯互为同分异构体 | |
| D. | 1mol该物质与浓溴水反应时最多消耗Br23mol |
1.5月3日,广东省发现部分患者使用了齐齐哈尔第二制药有限公司生产的“亮菌甲素注射液”后,出现了严重不良反应,并有多人死亡.目前这起假药案的成因已经水落石出:该公司采购人员在购买药用辅料丙二醇(结构简式为HOCH2CH2CH2OH)时,为图便宜,购入了假冒丙二醇的二甘醇(结构简式为HOCH2CH2-O-CH2CH2OH)并作为辅料用于“亮菌甲素注射液”的生产,从而酿成多人死伤的惨剧.关于丙二醇与二甘醇的说法中正确的是( )
| A. | 丙二醇与二甘醇互为同系物 | |
| B. | 丙二醇和二甘醇都互为同分异构体 | |
| C. | 1 mol丙二醇与二甘醇的混合物可以与足量金属钠反应生成22.4 L氢气 | |
| D. | 丙二醇与二甘醇都能发生取代反应 |
18.下列有关化学键与晶体结构的叙述正确的是( )
| A. | 离子晶体在熔化时,离子键被破坏;而分子晶体熔化时,化学键不被破坏 | |
| B. | 12g金刚石中,含C-C共价键键数为4mol | |
| C. | 水晶、干冰熔化时克服粒子间作用力的类型相同 | |
| D. | 熔点由高到低的顺序是:晶体硅>碳化硅>金刚石 |
19.下列物质中,属于高分子化合物的是( )
①蛋白质 ②氨基酸 ③油脂 ④淀粉 ⑤乙烷 ⑥纤维素 ⑦聚乙烯.
①蛋白质 ②氨基酸 ③油脂 ④淀粉 ⑤乙烷 ⑥纤维素 ⑦聚乙烯.
| A. | 只有①⑦ | B. | 除②外都是 | C. | 只有①④⑥⑦ | D. | 只有①③ |
 .
.