题目内容
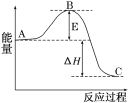
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)氧化为1molSO3(g)的ΔH=-99kJ/mol.
2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)氧化为1molSO3(g)的ΔH=-99kJ/mol.
请回答下列问题:
(1)图中A、C分别表示___、___,E的大小对该反应的反应热有无影响?____。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?___,理由是____。
(2)图中ΔH=___kJ/mol.
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:____。
(4)如果反应速率v(SO2)为0.05mol/(L·min),则v(O2)=___mol/(L·min)、v(SO3)=____mol/(L·min)。
(5)已知单质硫的燃烧热为296kJ/mol,计算由S(s)生成3molSO3(g)的ΔH(要求计算过程)。____
【答案】反应物能量 生成物能量 没有影响 降低 因为催化剂改变了反应历程,使活化能E降低 -198 SO2+V2O5=SO3+2VO2、VO2+O2=2V2O5 0.025 0.05 3S(s)+![]() O2(g)=3SO3(g) ΔH=(ΔH1+ΔH2)×3=-1185kJ/mol
O2(g)=3SO3(g) ΔH=(ΔH1+ΔH2)×3=-1185kJ/mol
【解析】
(1) A代表反应物能量、C代表生成物能量;由图像可知E代表活化能,和反应热无关。催化剂能降低反应的活化能,改变了反应的历程,从而加快反应速率。
答案为:反应物能量;生成物能量;降低;因为催化剂改变了反应历程,使活化能E降低
(2) 1 mol SO2(g)氧化为1 mol SO3(g)的ΔH = - 99 kJ/mol,而方程式中二氧化硫是2mol,所以ΔH = - 198 kJ/mol。
答案为:- 198;(3)根据所给元素化合价的变化可写出反应的方程式,SO2+V2O5=SO3+2VO2,4VO2+O2=2V2O5;答案为:SO2 + V2O5=SO3 + 2VO2,4VO2+O2=2V2O5;
(4)因为化学反应速率之比是相应的化学计量数之比,所以v (O2)=0.025mol/(L·min)、v(SO3)=0.05mo/(L·min);
答案为:0.025;0.05;
(5)考查盖斯定律的应用。由反应①2SO2(g)+ O2(g)![]() 2SO3(g) ΔH= - 198 kJ/mol和②S (s)+ O2(g)
2SO3(g) ΔH= - 198 kJ/mol和②S (s)+ O2(g)![]() SO2(g) ΔH= - 296 kJ/mol联立即①+②×2得2S(s)+ 3O2(g)
SO2(g) ΔH= - 296 kJ/mol联立即①+②×2得2S(s)+ 3O2(g)![]() 2SO3(g) ΔH =-790 kJ/mol,所以由S(s)生成3 mol SO3(g)的ΔH =
2SO3(g) ΔH =-790 kJ/mol,所以由S(s)生成3 mol SO3(g)的ΔH =![]() =1185 kJ/mol。
=1185 kJ/mol。
答案为:3S(s)+![]() O2(g)=3SO3(g) ΔH=(ΔH1+ΔH2)×3=-1185kJ/mol
O2(g)=3SO3(g) ΔH=(ΔH1+ΔH2)×3=-1185kJ/mol