题目内容
【题目】某化学小组为了证明二氧化硫和氯气的漂白性,设计了如下图所示的实验装置:
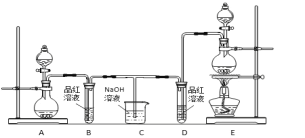
他们制备二氧化硫和氯气所依据的原理分别是:
Na2SO3+H2SO4 = Na2SO4+H2O+SO2↑
MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)用来制取氯气的装置是______(填字母),反应中浓盐酸所表现出________________性质。
(2)反应开始一段时间后,B、D试管中的品红溶液均退色。停止通气后,再给B、D两个试管分别加热____ (填" B”或“D")试管中无明显现象。
(3)装置C的作用是________________________;
(4)若装置D中的品红溶液换成紫色的石蕊溶液,则出现的现象是____________________________;
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不退色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是:________________________________。
【答案】E 还原性、酸性 D 吸收多余的SO2和Cl2 紫色石蕊试液先变红后褪色 SO2+Cl2+2H2O═2HCl+H2SO4
【解析】
(1)根据反应物的状态和反应条件选择反应装置,根据氯元素的化合价判断其表现的性质;
(2)次氯酸的漂白性是利用次氯酸的强氧化性,二氧化硫的漂白性是利用二氧化硫和有色物质生成无色物质,注意次氯酸的漂白性是永久性的,二氧化硫的漂白性是暂时的;
(3)二氧化硫、氯气都有毒,不能排放在环境中.用NaOH溶液吸收二氧化硫生成氯化钠与次氯酸钠;
(4)次氯酸既有酸性又有漂白性,所以氯气通入紫色石蕊试液中现象是先变红后褪色;
(5)氯气有强氧化性,二氧化硫有还原性,二者能按1:1发生氧化还原反应而使气体失去漂白性。
(1)实验室制取氯气所用药品是固体和液体,反应条件是加热,所以应选用固液加热型装置,故选E;实验室制取氯气的反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,由HCl生成MnCl2,氯元素化合价不变,由HCl生成Cl2,氯元素化合价升高,所以浓盐酸所表现出的性质是酸性和还原性,故答案为:E;还原性、酸性;
MnCl2+Cl2↑+2H2O,由HCl生成MnCl2,氯元素化合价不变,由HCl生成Cl2,氯元素化合价升高,所以浓盐酸所表现出的性质是酸性和还原性,故答案为:E;还原性、酸性;
(2)次氯酸的漂白性是利用次氯酸的强氧化性,二氧化硫的漂白性是利用二氧化硫和有色物质生成无色物质,次氯酸的漂白性是永久性的,二氧化硫的漂白性是暂时的;加热时,次氯酸漂白过的溶液无变化,二氧化硫和有色物质生成的无色物质不稳定,加热时能重新变成红色,故答案为:D;
(3)氯气和二氧化硫有毒,不能排放到空气中,但氯气和二氧化硫都和碱反应,所以装置C的作用是吸收多余的氯气和二氧化硫,故答案为:吸收多余的SO2和Cl2;
(4)次氯酸既有酸性又有漂白性,所以氯气通入紫色石蕊试液中现象是先变红后褪色,故答案为:紫色石蕊试液先变红后褪色;
(5)氯气有强氧化性,二氧化硫有还原性,二者能按1:1发生氧化还原反应:SO2+Cl2+2H2O═2HCl+H2SO4 生成无漂白性的H2SO4和HCl,故答案为:SO2+Cl2+2H2O═2HCl+H2SO4。

 名校课堂系列答案
名校课堂系列答案【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
A | 酸性高锰酸钾 | 浓盐酸 | NaHCO3溶液 | Cl2与水反应生成酸性物质 |
B | 浓硫酸 | 蔗糖 | 澄清石灰水 | 浓硫酸具有脱水性、氧化性 |
C | 浓硝酸 | 铁片 | NaOH溶液 | 铁和浓硝酸反应可生成NO |
D | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
A. A B. B C. C D. D