题目内容
【题目】在50 mL 4 mol·L-1的氢氧化钠溶液中,通入一定量的硫化氢,反应完毕,在常温减压条件下,用氮气把溶液吹干,得到白色固体7.92 g,通过计算确定白色固体的组成及各组分的质量。_________________
【答案】白色固体有两种组合。一种可能是由Na2S(3.12g)和NaOH(4.80g)组成的混合物;另一种可能是由Na2S(7.52 g)和NaHS(0.40 g)组成的混合物。
【解析】
NaOH的物质的量为n(NaOH)=c·V=4mol/L× 0.05L =0.2mol,0.2mol的NaOH跟H2S反应,若全部生成Na2S时,白色固体的质量m(Na2S)=78g/mol×![]() =7.8g,0.2mol的NaOH跟H2S反应,若全部生成NaHS时,白色固体(NaHS)的质量为m(NaHS)=56g/mol×0.2mol=11.2g,因为7.8g<7.92g<11.2g,所以得到的白色固体有两种可能的组合:一种是Na2S和NaOH的混合物;另一种是Na2S和NaHS的混合物,根据题意列方程式进行计算即可。
=7.8g,0.2mol的NaOH跟H2S反应,若全部生成NaHS时,白色固体(NaHS)的质量为m(NaHS)=56g/mol×0.2mol=11.2g,因为7.8g<7.92g<11.2g,所以得到的白色固体有两种可能的组合:一种是Na2S和NaOH的混合物;另一种是Na2S和NaHS的混合物,根据题意列方程式进行计算即可。
氢氧化钠的物质的量为n(NaOH)=c·V=4mol/L× 0.05L =0.2mol,0.2mol的NaOH跟H2S反应,若全部生成Na2S时,m(Na2S)=78g/mol×![]() =7.8g;0.2 mol的NaOH跟H2S反应,若全部生成NaHS时,m(NaHS)=56g/mol×0.2mol=11.2g,因为7.8 g<7.92 g<11.2 g,所以得到的白色固体有两种可能的组合:①Na2S和NaOH的混合物;②Na2S和NaHS的混合物。
=7.8g;0.2 mol的NaOH跟H2S反应,若全部生成NaHS时,m(NaHS)=56g/mol×0.2mol=11.2g,因为7.8 g<7.92 g<11.2 g,所以得到的白色固体有两种可能的组合:①Na2S和NaOH的混合物;②Na2S和NaHS的混合物。
①设Na2S为xmol,则有(0.2-2x) mol NaOH,78 g/mol×xmol+40g/mol(0.2-2x)=7.92g,解得x=0.04mol;Na2S的质量m(Na2S)=0.04 mol×78 g/mol=3.12g,NaOH的质量m(NaOH)=7.92 g-3.12g=4.80 g;
②设Na2S为ymol,则有(0.2-2y)mol NaHS。78 g/mol×ymol+56g·mol(0.2-2y)mol=7.92g,解得y≈0.0965 mol,所以Na2S的质量m(Na2S)=78g/mol×0.0965 mol=7.52g,NaHS的质量m(NaHS)=7.92 g-7.52g=0.40g。

 阅读快车系列答案
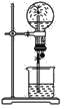
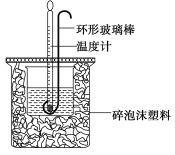
阅读快车系列答案【题目】实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
试完成下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是____________________。
不能用铜丝搅拌棒代替环形玻璃棒的理由是_____________________。
(2)经数据处理,t2—t1=3.4 ℃。则该实验测得的中和热ΔH=________[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1__________ΔH(填“<”、“>”或“=”),理由是_______________。