��Ŀ����
����Ŀ����֪25��ʱ����������ʵĵ���ƽ�ⳣ�����������ʾ���ش��������⣺
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | Ka=1.8��10��5 | Ka1=4.3��10��7 | Ka=3.0��10��8 |
��1�����ʵ���Ũ�Ⱦ�Ϊ0.1molL��1��������Һ�� a��CH3COONa b��Na2CO3 c��NaClO d��NaHCO3
pH��С�������е�˳�������ñ����д����
��2�������£�0.1molL��1 CH3COOH��Һ��ˮϡ�����У����б���ʽ�����ݱ�����������ĸ����
A.c��H+��
B.![]()
C.c��H+��c��OH����
D.![]()
E.![]()
��3��д�������������Һ��ͨ������������̼�����ӷ���ʽ�� ��
��4��25��ʱ��CH3COOH��CH3COONa�Ļ����Һ������û��ҺpH=6������Һ��c��CH3COO������c��Na+��=����ȷ��ֵ����
��5��25��ʱ����a molL��1�Ĵ�����b molL��1�������Ƶ������ϣ���Ӧ����Һǡ�������ԣ���a��b��ʾ����ĵ���ƽ�ⳣ��Ϊ ��
��6�������Ϊ100mL pH=2��CH3COOH��һԪ��HX����ˮϡ������pH����Һ����Ĺ�ϵ��ͼ��ʾ����HX�ĵ���ƽ�ⳣ��������ڡ�����С�ڡ����ڡ���CH3COOH�ĵ���ƽ�ⳣ���� 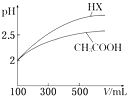
��7����״���£���1.12L CO2ͨ��100mL 1molL��1��NaOH��Һ�У�����Һ������Ũ�ȷ���������е�ʽ�� ��c��OH����=2c��H2CO3��+ ��
��c��H+��+c��Na+��= ��
���𰸡�
��1��a��d��c��b
��2��BD
��3��ClO��+H2O+CO2=HCO3��+HClO
��4��9.9��10��7mol?L��1
��5��![]()
��6������
��7��c��HCO3����+c��H+����2c��CO32����+c��HCO3����+c��OH����
���������⣺��1���ݵ���ƽ�ⳣ����֪��������ǿ������˳��Ϊ��CH3COOH��H2CO3��HClO��HCO3�� �� ���������Խ����������ӵ�ˮ��̶�Խ����Һ����Խǿ������pH��С��������˳����a��d��c��b�����Դ��ǣ�a��d��c��b����2��0.1mol/L��CH3COOH��Һ��ˮϡ�����У��������������������ʵ�������Ũ�ȼ�С�����Լ�����A��������Ũ�ȼ�С���ʴ��� B����ˮϡ�����У����������ʵ���������������ʵ�����С������ ![]() ������ȷ��
������ȷ��
C��ˮ�����ӻ��������䣬�ʴ���
D��������Һ��ˮϡ��ʱ���Լ�����������Ũ�ȼ�С����������Ũ���������� ![]() ������ȷ��
������ȷ��
E������ĵ���ƽ�ⳣ�����䣬�ʴ���
���Դ��ǣ�BD����3�������������ǿ��̼������������ӣ���Ӧ����̼��������ӣ���Ӧ�����ӷ���ʽΪ��ClO��+H2O+CO2=HCO3��+HClO�����Դ��ǣ�ClO��+H2O+CO2=HCO3��+HClO��4��CH3COOH��CH3COONa�Ļ����Һ�У����ڵ���غ㣺c��Na+��+c��H+��=c��OH����+c��CH3COO����������c��CH3COO������c��Na+��=c��H+����c��OH����=10��6mol/L��10��8mol/L=9.9��10��7mol/L��
���Դ��ǣ�9.9��10��7molL��1����5����amolL��1�Ĵ�����Һ��b molL��1������������Һ�������ϣ���Һ�����ԣ�˵��������������������������Һ������ӦCH3COOH+NaOH=CH3COONa+H2O������Һ��c��CH3COOH��= ![]() molL��1 �� �ﵽ����ƽ��ʱ����Һ�����ԣ�������Ũ����1��10��7molL��1 �� c��Na+��=c��CH3COO����=
molL��1 �� �ﵽ����ƽ��ʱ����Һ�����ԣ�������Ũ����1��10��7molL��1 �� c��Na+��=c��CH3COO����= ![]() molL��1 �� ��k=
molL��1 �� ��k= ![]() =
= ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ����6��pH��ȵ����У���ˮϡ�ʹٽ�������룬ϡ����ͬ�ı�����pH�仯���Ϊǿ�ᣬС��Ϊ���ᣬ����HX�����Դ��ڴ��ᣬ��HX�ĵ���ƽ�ⳣ�����ڴ��ᣬ
����6��pH��ȵ����У���ˮϡ�ʹٽ�������룬ϡ����ͬ�ı�����pH�仯���Ϊǿ�ᣬС��Ϊ���ᣬ����HX�����Դ��ڴ��ᣬ��HX�ĵ���ƽ�ⳣ�����ڴ��ᣬ
���Դ��ǣ����ڣ���7����״���£���1.12L CO2ͨ��100mL 1molL��1��NaOH��Һ�У�1.12L CO2�����ʵ���Ϊ�� ![]() =0.05mol���������Ƶ����ʵ���Ϊ��1molL��1��0.1L=0.1mol������ǡ����ȫ��Ӧ����̼���ƣ������غ�ã�c��OH����=2c��H2CO3��+c��HCO3����+c��H+��������غ㣺c��H+��+c��Na+��=2c��CO32����+c��HCO3����+c��OH���������Դ��ǣ���c��HCO3����+c��H+������2c��CO32����+c��HCO3����+c��OH������
=0.05mol���������Ƶ����ʵ���Ϊ��1molL��1��0.1L=0.1mol������ǡ����ȫ��Ӧ����̼���ƣ������غ�ã�c��OH����=2c��H2CO3��+c��HCO3����+c��H+��������غ㣺c��H+��+c��Na+��=2c��CO32����+c��HCO3����+c��OH���������Դ��ǣ���c��HCO3����+c��H+������2c��CO32����+c��HCO3����+c��OH������
�����㾫�����������⣬������Ҫ�˽����������ˮ��Һ�еĵ���ƽ��(��������ʷ����������ӵ����ʵ��ڽ�ϳɷ��ӵ�����ʱ��������ʵĵ���ʹ��ڵ���ƽ��״̬������ƽ���ǻ�ѧƽ���һ�֣�ͬ�����л�ѧƽ��������������ı�ʱƽ���ƶ��Ĺ��ɷ�����ɳ����ԭ��)��

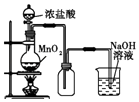
����Ŀ����ͼ��ʵ�����Ʊ�����������һϵ�����ʵ���װ�ã��г��豸���ԣ���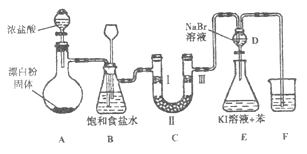
��1��װ��A�������ķ���װ�ã���д���÷�Ӧ��Ӧ�Ļ�ѧ����ʽ:��
��2��װ��B�б���ʳ��ˮ����������ͬʱװ��BҲ�ǰ�ȫƿ�����ʵ�����ʱC���Ƿ�����������д����������ʱB�е�����:��
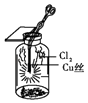
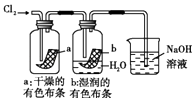
��3��װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ�Ϊ��C��I�������η������ʵ����Ӧ��������ĸ��ţ���
��� | I | �� | �� |
a | �������ɫ���� | ��ʯ�� | ʪ�����ɫ���� |
b | �������ɫ���� | ��ˮ����ͭ | ʪ�����ɫ���� |
c | ʪ�����ɫ���� | Ũ���� | �������ɫ���� |
d | ʪ�����ɫ���� | ��ˮ�Ȼ��� | �������ɫ���� |
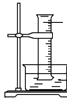
��4�����װ��D��E��Ŀ���DZȽ��ȡ��塢�ⵥ�ʵ������ԡ���Ӧһ��ʱ���������װ��D��������Һ����װ��E�У����۲쵽�������� �� ����������ܡ����ܡ��� ˵���嵥�ʵ�������ǿ�ڵ⣬ԭ������
��5��װ��F���ձ��е���Һ����ѡ�������е�������ĸ��ţ���a.����NaOH��Һ b.����Ca��OH��2��Һ c.����Na2CO3��Һ