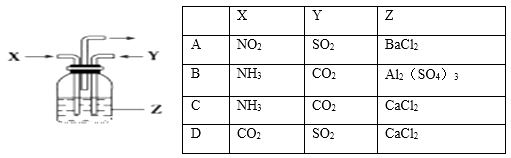
��Ŀ����
����Ŀ��ͭ�����ã����������һ����ɫ���壬Ϊ�˽�ͭ�ڿ����еĸ�ʴ�����ij��ѧ��ȤС���ռ�����ͭ���������ɫ�������̽��������������Ϻ������ɫ���ʿ�����ͭ��̼���Σ� ��С��ͬѧ������ͼװ�ý���ʵ�飮
�ٶ��Թ��ڵ���ɫ������м��ȣ�����ȫ�ֽ⣬�۲쵽Aװ������ɫ������ɺ�ɫ��Bװ������ˮ����ͭ�����ɫ��Cװ���г���ʯ��ˮ����ǣ�
��ȡ�������Ⱥ����ɵĺ�ɫ�������Թ��У�����ϡ���ᣮ�۲쵽��ɫ�������ܽ⣬��Һ�����ɫ��
��ȡ����������ɫ��Һ�����Թ��У�����һ���ྻ����˿���۲쵽��˿�����к�ɫ����������
��ش��������⣺
��1����ɫ�����к��е�Ԫ���� ��
��2�����Ⱥ��Թ���ʣ��ĺ�ɫ������ ��
��3���������ɫ������һ�ִ�������仯ѧʽ������ �� ���ȷֽ�Ļ�ѧ����ʽΪ ��
��4������ʵ�鲽����еķ�Ӧ�����ӷ���ʽΪ ��
��5��ʵ��װ�����ĸ���ܵ������� ��
��6�������B��C��װ�öԵ����ܷ�ﵽʵ��Ŀ�ģ� �� Ϊʲô�� ��
���𰸡�
��1��Cu��H��O��C
��2��CuO
��3��Cu2��OH��2CO3�� Cu2��OH��2CO3![]() ?2CuO+H2O��+CO2��
?2CuO+H2O��+CO2��
��4��Fe+Cu2+�TCu+Fe2+
��5����ֹ�����е�CO2������ƿ
��6�����ܣ��Ե�����˵����Ӧ����ˮ����
���������⣺��1����ˮ����ͭ�ܺ�ˮ��Ӧ������ɫ������ͭ���壬��ɫ������ȣ�����ȫ�ֽ⣬Bװ������ˮ����ͭ�����ɫ��˵����Ӧ��ˮ���ɣ��Ӷ���ȷ�������к����⡢��Ԫ�أ�Cװ���г���ʯ��ˮ����ǣ�˵�������˶�����̼����ȷ�������к���̼����Ԫ�أ�ͭ���ϳ��ֵĹ��壬Aװ������ɫ������ɺ�ɫ�����ɫ�������������ͭ������ϡ���ᣮ�۲쵽��ɫ�������ܽ⣬��Һ�����ɫ��˵����ɫ����һ��������ͭ��ԭ�����к���ͭ����Ԫ�أ�������ɫ���������к����⡢̼������ͭ��
���Դ��ǣ�Cu��C��H��O����2������ͭΪ��ɫ���壬����ͭ��ҺΪ��ɫ��Һ��ȡ�������Ⱥ����ɵĺ�ɫ�������Թ��У�����ϡ���ᣬ�۲쵽��ɫ�������ܽ⣬��Һ�����ɫ�����ɫ����ΪCuO��
���Դ��ǣ�CuO����3���������ɫ������һ�ִ���������Ԫ�غ�Ԫ�صĻ��ϼۿ�֪������Ӧ�Ǽ�ʽ�Σ��仯��ʽΪ��Cu2��OH��2CO3����ʽ̼��ͭ���ȷֽ���������ͭ��������̼��ˮ����Ӧ�ķ���ʽΪ��Cu2��OH��2CO3 ![]() 2CuO+H2O��+CO2����
2CuO+H2O��+CO2����
���Դ��ǣ�Cu2��OH��2CO3��Cu2��OH��2CO3 ![]() 2CuO+H2O��+CO2������4���������Fe��ͭ���ӷ�Ӧ����Cu���������ӣ��䷴Ӧ�����ӷ���ʽΪ��Fe+Cu2+=Cu+Fe2+��
2CuO+H2O��+CO2������4���������Fe��ͭ���ӷ�Ӧ����Cu���������ӣ��䷴Ӧ�����ӷ���ʽΪ��Fe+Cu2+=Cu+Fe2+��
���Դ��ǣ�Fe+Cu2+=Cu+Fe2+����5��װ��C�Ǽ��������̼�ģ�Ҫ��������еĶ�����̼����C�����������ţ�����ʵ��װ�����ĸ���ܵ������Ƿ�ֹ�����е�CO2������ƿ��
���Դ��ǣ���ֹ�����е�CO2������ƿ����6�������B��C��װ�öԵ�������ͨ��C�����ˮ����������ȷ��������ɫ�����Ƿ���ˮ���ɣ�
���Դ��ǣ����ܣ��Ե�����˵����Ӧ����ˮ���ɣ�

����Ŀ����֪25��ʱ����������ʵĵ���ƽ�ⳣ�����������ʾ���ش��������⣺
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | Ka=1.8��10��5 | Ka1=4.3��10��7 | Ka=3.0��10��8 |
��1�����ʵ���Ũ�Ⱦ�Ϊ0.1molL��1��������Һ�� a��CH3COONa b��Na2CO3 c��NaClO d��NaHCO3
pH��С�������е�˳�������ñ����д����
��2�������£�0.1molL��1 CH3COOH��Һ��ˮϡ�����У����б���ʽ�����ݱ�����������ĸ����
A.c��H+��
B.![]()
C.c��H+��c��OH����
D.![]()
E.![]()
��3��д�������������Һ��ͨ������������̼�����ӷ���ʽ�� ��
��4��25��ʱ��CH3COOH��CH3COONa�Ļ����Һ������û��ҺpH=6������Һ��c��CH3COO������c��Na+��=����ȷ��ֵ����
��5��25��ʱ����a molL��1�Ĵ�����b molL��1�������Ƶ������ϣ���Ӧ����Һǡ�������ԣ���a��b��ʾ����ĵ���ƽ�ⳣ��Ϊ ��
��6�������Ϊ100mL pH=2��CH3COOH��һԪ��HX����ˮϡ������pH����Һ����Ĺ�ϵ��ͼ��ʾ����HX�ĵ���ƽ�ⳣ��������ڡ�����С�ڡ����ڡ���CH3COOH�ĵ���ƽ�ⳣ���� 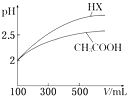
��7����״���£���1.12L CO2ͨ��100mL 1molL��1��NaOH��Һ�У�����Һ������Ũ�ȷ���������е�ʽ�� ��c��OH����=2c��H2CO3��+ ��
��c��H+��+c��Na+��= ��