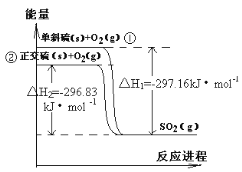
题目内容
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表,下列说法正确的是
2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表,下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2min的平均速率v(Z)=2.0×10—3mol/(L·min)
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)<v(正)
C. 该温度下此反应的平衡常数K=144
D. 其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大
【答案】B
【解析】反应前2min消耗Y的物质的量是0.04mol,则生成z的物质的量是0.08mol,v(Z)=![]() 4.0×10—3mol/(L·min),故A错误;X(g)+Y(g)
4.0×10—3mol/(L·min),故A错误;X(g)+Y(g)![]() 2Z(g) ΔH<0,其他条件不变,降低温度平衡正向移动,反应达到新平衡前v(逆)<v(正),故B正确;
2Z(g) ΔH<0,其他条件不变,降低温度平衡正向移动,反应达到新平衡前v(逆)<v(正),故B正确;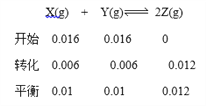
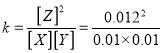 =1.44,故C错误;其他条件不变,再充入0.2mol Z,相当于加压,加压平衡不移动,平衡时X的体积分数不变,故D错误。
=1.44,故C错误;其他条件不变,再充入0.2mol Z,相当于加压,加压平衡不移动,平衡时X的体积分数不变,故D错误。

【题目】工业上用含有铝、铁、铜的废弃合金为主要原料制取硫酸铝溶液、硝酸铜晶体和无水氯化铁,其生产流程如图所示。

已知:
沉淀物 | Fe(OH)3 | Cu(OH)2 |
开始沉淀的pH | 1.9 | 4.7 |
沉淀完全的pH | 3.2 | 6.7 |
(1)在滤液A中直接加入硫酸后所得到的硫酸铝溶液中除含少量硫酸外,还一定含有的杂质是______(填化学式)。
(2)请设计一个更合理的实验方案由滤液A制备纯净的硫酸铝溶液,写出相关的两个离子方程式______、______。
(3)将溶液C调节pH,pH的范围是______。
A.3.2≤pH≤4.7 B.3.2≤pH<4.7 C.3.2<pH<4.7D.3.2<pH≤4.7
(4)要制得更纯的Cu(NO3)2·6H2O晶体,可进行的操作是______(填操作名称)。
(5)操作Ⅱ的具体操作是______。