题目内容
【题目】单斜硫和正交硫转化为二氧化硫的能量变化如右图所示,下列说法正确的是
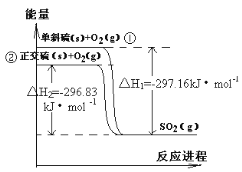
A.S(s,单斜) = S(s,正交) △H = +0.33kJ/mol
B.正交硫比单斜硫稳定
C.相同物质的量的正交硫比单斜硫所含有的能量高
D.1molSO2(g)分解成lmol S(s,单斜)和lmol O2(g)时会放出热量
【答案】B
【解析】
试题分析:A.根据图示可知单斜硫的能量比正交硫的能量高,所以S(s,单斜)=S(s,正交) △H=-0.33 kJ/mol,A错误;B.相同物质的量的正交硫比单斜硫所含有的能量低,能量越低越稳定,则正交硫比单斜硫稳定,B正确;C.相同物质的量的正交硫比单斜硫所含有的能量低,C错误;D.S燃烧放热,则SO2分解吸热,D错误,答案选B。

【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表,下列说法正确的是
2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表,下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2min的平均速率v(Z)=2.0×10—3mol/(L·min)
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)<v(正)
C. 该温度下此反应的平衡常数K=144
D. 其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大
【题目】A、B、C、D、E是中学化学中五种常见元素,有关信息如下:
元素 | 有关信息 |
A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
B | 地壳中含量最多的元素 |
C | 单质须保存在煤油中 |
D | 单质与NaOH溶液反应可用于生产漂白液 |
E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
请回答下列问题:
(1)A的氢化物分子的电子式是 , 其最高价氧化物对应的水化物与其氢化物反应的离子方程式: .
(2)B,C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为 .
(3)A、D的氢化物相互反应,产生白色固体,对该固体中阳离子存在检验的操作方法及现象是: , 证明存在该阳离子.