题目内容
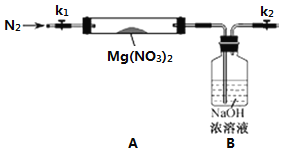
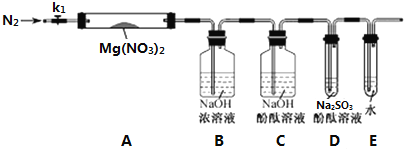
【题目】工业上用含有铝、铁、铜的废弃合金为主要原料制取硫酸铝溶液、硝酸铜晶体和无水氯化铁,其生产流程如图所示。

已知:
沉淀物 | Fe(OH)3 | Cu(OH)2 |
开始沉淀的pH | 1.9 | 4.7 |
沉淀完全的pH | 3.2 | 6.7 |
(1)在滤液A中直接加入硫酸后所得到的硫酸铝溶液中除含少量硫酸外,还一定含有的杂质是______(填化学式)。
(2)请设计一个更合理的实验方案由滤液A制备纯净的硫酸铝溶液,写出相关的两个离子方程式______、______。
(3)将溶液C调节pH,pH的范围是______。
A.3.2≤pH≤4.7 B.3.2≤pH<4.7 C.3.2<pH<4.7D.3.2<pH≤4.7
(4)要制得更纯的Cu(NO3)2·6H2O晶体,可进行的操作是______(填操作名称)。
(5)操作Ⅱ的具体操作是______。
【答案】 K2SO4 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- Al(OH)3+H+=Al3++2H2O B 重结晶 在HCl气流中加热三氯化铁晶体
【解析】试题分析:金属铝可以与氢氧化钾、水反应生成偏铝酸钾和氢气,过量的氢氧化钾会与硫酸反应生成硫酸钾,所以滤液A中肯定还含有硫酸钾,由于偏铝酸根离子在弱酸的条件下可生成沉淀氢氧化铝,所以由滤液A制备纯净的硫酸铝溶液流程为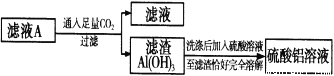 ;根据流程图将溶液C调节pH的目的是让Fe3+水解生成氢氧化铁沉淀而除去;要制得更纯的Cu(NO3)2·6H2O晶体,必须进行的操作是重结晶。操作Ⅱ是加热氯化铁晶体获得无水无水氯化铁,要防止Fe3+水解生成氢氧化铁。
;根据流程图将溶液C调节pH的目的是让Fe3+水解生成氢氧化铁沉淀而除去;要制得更纯的Cu(NO3)2·6H2O晶体,必须进行的操作是重结晶。操作Ⅱ是加热氯化铁晶体获得无水无水氯化铁,要防止Fe3+水解生成氢氧化铁。
解析:根据以上分析,(1).过量的氢氧化钾会与硫酸反应生成硫酸钾,所以滤液A中肯定还含有K2SO4;(2)由于偏铝酸根离子在弱酸的条件下可生成沉淀氢氧化铝,所以由滤液A制备纯净的硫酸铝溶液流程为 ,反应离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 、 Al(OH)3+H+=Al3++2H2O;(3)根据流程图将溶液C调节pH的目的是让Fe3+水解生成氢氧化铁沉淀而除去,pH的范围是3.2≤pH<4.7,选B;(4)要制得更纯的Cu(NO3)2·6H2O晶体,必须进行的操作是重结晶;(5)操作Ⅱ是加热氯化铁晶体获得无水氯化铁,要防止Fe3+水解生成氢氧化铁,所以操作Ⅱ是在HCl气流中加热三氯化铁晶体。
,反应离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 、 Al(OH)3+H+=Al3++2H2O;(3)根据流程图将溶液C调节pH的目的是让Fe3+水解生成氢氧化铁沉淀而除去,pH的范围是3.2≤pH<4.7,选B;(4)要制得更纯的Cu(NO3)2·6H2O晶体,必须进行的操作是重结晶;(5)操作Ⅱ是加热氯化铁晶体获得无水氯化铁,要防止Fe3+水解生成氢氧化铁,所以操作Ⅱ是在HCl气流中加热三氯化铁晶体。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一,研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-53.7kJmol-1 I
CH3OH(g)+H2O(g) △H1=-53.7kJmol-1 I
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2 II
CO(g)+H2O(g) △H2 II
某实验室控制CO2和H2初始投料比为1︰2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJmol-1和-285.8kJmol-1。
②H2O(l)=H2O(g) △H3=+44.0kJmol-1
请回答(不考虑温度对△H的影响):
(1)反应I的平衡常数表达式K=______;反应II的△H2=______kJmol-1.
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有__________。
A.使用催化剂Cat.1 B.使用催化剂Cat.2
C.降低反应温度 D.投料比不变,增加反应物的浓度
E.增大 CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是___________________________。
(4)在如图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图_________。

(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在______极,该电极反应式是_________。
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表,下列说法正确的是
2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表,下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2min的平均速率v(Z)=2.0×10—3mol/(L·min)
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)<v(正)
C. 该温度下此反应的平衡常数K=144
D. 其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大