题目内容
【题目】下列说法正确的是
A. 常温时硅化学性质不活泼,不能与任何物质反应
B. 晶体硅具有金属光泽,可以导电,属于金属材料
C. Na2SiO3是制备硅胶和木材防火剂的原料
D. 二氧化硅是将太阳能转化为电能的常用材料
【答案】C
【解析】A.常温下硅可与强碱、HF酸反应,故A错误;B.Si导电性介于金属和绝缘体之间,为半导体材料,故B错误;C.硅酸钠是制备硅胶和木材防火剂的原料,故C正确;D.二氧化硅不导电,Si为良好的半导体材料,则Si是将太阳能转化为电能的常用材料,故D错误;答案为C。

【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表,下列说法正确的是
2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表,下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2min的平均速率v(Z)=2.0×10—3mol/(L·min)
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)<v(正)
C. 该温度下此反应的平衡常数K=144
D. 其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气.为了验证哪位同学的判断正确,丙同学设计了如图1所示实验装置(锌与浓硫酸共热时产生的气体为X,气体发生装置略去).试回答: 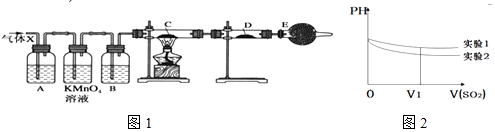
(1)上述反应中生成二氧化硫的化学方程式为 .
(2)乙同学认为还可能产生氢气的理由是 .
(3)A中加入的试剂可能是 , 作用是;B中加入的试剂可能是 , 作用是;
(4)可以证明气体X中含有氢气的实验现象是:C中: , D中: .
(5)II.该小组同学将收集的SO2气体通入0.1molL﹣1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2 , 该小组提出了如下假设: 假设一:溶液中的NO3﹣
假设二:溶液中溶解的O2
该小组设计实验验证了假设一,
请在下表空白处填写相关实验现象
实验步骤 | 实验现象 | 结论 |
实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 假设一成立 | |
实验2:在盛有不含O2的25ml0.1mol/LBa(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 |
(6)为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线如图2,实验1中溶液pH变小的原因是V1时,实验2中溶液pH小于实验1的原因是(用离子方程式表示) .
【题目】A、B、C、D、E是中学化学中五种常见元素,有关信息如下:
元素 | 有关信息 |
A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
B | 地壳中含量最多的元素 |
C | 单质须保存在煤油中 |
D | 单质与NaOH溶液反应可用于生产漂白液 |
E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
请回答下列问题:
(1)A的氢化物分子的电子式是 , 其最高价氧化物对应的水化物与其氢化物反应的离子方程式: .
(2)B,C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为 .
(3)A、D的氢化物相互反应,产生白色固体,对该固体中阳离子存在检验的操作方法及现象是: , 证明存在该阳离子.