题目内容
17.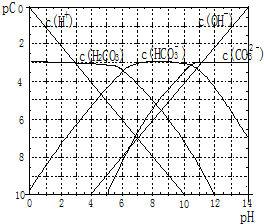 pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中该溶质的pC=-lg1×10-3=3.已知H2CO3溶液中存在的化学平衡为:CO2+H2O?H2CO3?H++HCO3-?2H++CO32-.如图为H2CO3溶液的pC-pH图.请回答下列问题:
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中该溶质的pC=-lg1×10-3=3.已知H2CO3溶液中存在的化学平衡为:CO2+H2O?H2CO3?H++HCO3-?2H++CO32-.如图为H2CO3溶液的pC-pH图.请回答下列问题:(1)在pH=0~4时,H2CO3溶液中主要存在的离子为:H+、HCO3-;在pH=12时,H2CO3溶液中主要存在的含碳阴离子为:CO32-、HCO3-;
(2)pH<5时,溶液中H2CO3的pC值总是约等于3的原因是二氧化碳溶液是饱和溶液,c(H+)增大后,平衡向左移动放出CO2,导致碳酸浓度保持不变;
(3)一定浓度的NaHCO3和Na2CO3混合溶液是一种“缓冲溶液”,在这种溶液中加入少量的强酸或强碱,溶液的pH变化不大,其原因是CO32-+H+=HCO3-;氢氧根离子能够与碳酸氢根离子中和生成碳酸根离子和水,HCO3-+OH-=H2O+CO32-,使溶液pH基本不变.
分析 (1)由图象可知,横坐标为pH,纵坐标为pC,由图象的曲线分析;
(2)“缓冲溶液”中加入少量的强酸或强碱,溶液的pH变化都不大,加入碱时与碳酸氢根离子反应;
(3)“缓冲溶液”中加入少量的强酸或强碱,溶液的pH变化都不大,加入强酸时氢离子与碳酸根离子反应,加入碱时与碳酸氢根离子反应;
解答 解:(1)由图象可知,横坐标为pH,纵坐标为pC,由图象的曲线可知,pH在0~4时,H2CO3溶液中主要存在的离子为H+、HCO3-;pH=12时,溶液中浓度最大的含碳元素离子为 CO32-、HCO3-,故答案为:H+、HCO3-;CO32-、HCO3-;
(2)由图象可知,横坐标为pH,纵坐标为pC,pH<5时,溶液中H2CO3的pC值总是约等于3是因二氧化碳溶液是饱和溶液,c(H+)增大后,平衡向左移动放出CO2,导致碳酸浓度保持不变,
故答案为:二氧化碳溶液是饱和溶液,c(H+)增大后,平衡向左移动放出CO2,导致碳酸浓度保持不变;
(3)“缓冲溶液”中加入少量的强酸或强碱,溶液的pH变化都不大,加入强酸时氢离子与碳酸根离子反应,离子方程式为:CO32-+H+=HCO3-,加入碱时与碳酸氢根离子反应,该离子反应为HCO3-+OH-=H2O+CO32-,
故答案为:CO32-+H+=HCO3-;氢氧根离子能够与碳酸氢根离子中和生成碳酸根离子和水,HCO3-+OH-=H2O+CO32-,使溶液pH基本不变.
点评 本题考查了弱电解质在溶液中的电离平衡,题目难度不大,解题关键是理解题中信息、分析图象信息,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
7.下列关于元素周期表的叙述,错误的是( )
| A. | 镁是第IIA族元素 | |
| B. | 第IA族元素全部是金属元素 | |
| C. | 氧族中含金属元素 | |
| D. | 第3周期中既有金属元素又有非金属元素 |
6.下列反应的离子方程式正确的是( )
| A. | 把金属铁放入稀硫酸中 2Fe+6H+=2Fe3++3H2↑ | |
| B. | 向Ca(ClO)2溶液中通入二氧化硫 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | |
| C. | 向Ca(HCO3)2溶液中加入足量的氢氧化钠溶液 Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | 向NH4HSO4稀溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全:NH4++H++SO42-+Ba2++2OH-=NH3•H2O+BaSO4↓+H2O |
7.将下列5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上 _____+____→_______+_______+_______+H2O 组成一个未配平的化学方程式,正确的顺序是( )
| A. | HNO3、FeSO4;Fe2(SO4)3、Fe(NO3)3、N2O | B. | Fe2(SO4)3、N2O;FeSO4、HNO3、Fe(NO3)3 | ||
| C. | HNO3、Fe2(SO4)3;FeSO4、Fe(NO3)3、N2O | D. | FeSO4、Fe(NO3)3;Fe2(SO4)3、HNO3、N2O |
 波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.胆矾CuSO4?5H2O可写成[Cu(H2O)4]SO4?H2O,其结构示意图如图:
波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.胆矾CuSO4?5H2O可写成[Cu(H2O)4]SO4?H2O,其结构示意图如图: ,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有K、Cr(填元素符号).
,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有K、Cr(填元素符号).