题目内容
8.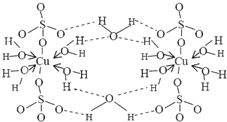 波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.胆矾CuSO4?5H2O可写成[Cu(H2O)4]SO4?H2O,其结构示意图如图:
波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.胆矾CuSO4?5H2O可写成[Cu(H2O)4]SO4?H2O,其结构示意图如图:(1)写出铜原子价层电子的轨道排布式
 ,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有K、Cr(填元素符号).
,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有K、Cr(填元素符号).(2)由图可知:胆矾中存在的作用力有abcd
a.离子键 b.配位键 c.氢键 d.极性键 e.非极性键
(3)往浓CuSO4溶液中加入过量较浓的NH3•H2O直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的C2H5OH并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色Cu(NH3)4SO4•H2O晶体.实验中所加C2H5OH的作用是加C2H5OH,减小“溶剂”(C2H5OH和H2O)的极性,降低离子化合物Cu(NH3)4SO4•H2O的溶解度.
(4)已知Cu(NH3)42+呈平面正方形结构,则Cu(NH3)4SO4•H2O晶体中呈正四面体的粒子是SO42-,杂化轨道类型是sp3的原子有N、S、O.
(5)如将深蓝色溶液加热,可能得到什么结果?加热,NH3挥发,生成Cu(OH)2蓝色沉淀[和(NH4)2SO4].
分析 (1)铜是29号元素,根据核外电子排布规律书写铜原子价层电子的轨道排布式,并判断与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素;
(2)由结构可知,晶体中铜离子与硫酸根之间存在离子键,水分子与铜离子之间存在配位键,氧原子与氢原子、氧原子与硫原子之间存在极性键,水分子之间存在氢键;
(3)加C2H5OH,减小“溶剂”(C2H5OH和H2O)的极性,降低离子化合物Cu(NH3)4SO4•H2O的溶解度,便于析出;
(4)Cu(NH3)42+呈平面正方形结构,水成角型,Cu(NH3)4SO4•H2O晶体中呈正四面体为SO42-;N、S、O杂化轨道类型是sp3;
(5)加热,NH3挥发,生成Cu(OH)2蓝色沉淀和(NH4)2SO4.
解答 解:(1)铜是29号元素,1s22s22p63s23p63d104s1,铜原子价层电子的轨道排布式为 ;铜原子最外层排布为4s1,同周期外层排布为4s1,为没有d能级的元素为K,d能级含有5个电子为Cr,
;铜原子最外层排布为4s1,同周期外层排布为4s1,为没有d能级的元素为K,d能级含有5个电子为Cr,
故答案为: ; K、Cr;
; K、Cr;
(2)由结构可知,晶体中铜离子与硫酸根之间存在离子键,水分子与铜离子之间存在配位键,氧原子与氢原子、氧原子与硫原子之间存在极性键,水分子之间存在氢键,
故选:abcd;
(3)加C2H5OH,减小“溶剂”(C2H5OH和H2O)的极性,降低离子化合物Cu(NH3)4SO4•H2O的溶解度,便于析出,
故答案为:加C2H5OH,减小“溶剂”(C2H5OH和H2O)的极性,降低离子化合物Cu(NH3)4SO4•H2O的溶解度,便于析出;
(4)Cu(NH3)42+呈平面正方形结构,水成角型,Cu(NH3)4SO4•H2O晶体中呈正四面体为SO42-;SO42-是正四面体结构,S杂化轨道类型是sp3,氨分子中含有3个N-H键、氮原子有1对孤对电子对,杂化轨道数为4,氮原子采取sp3杂化,水分子中含有2个O-H键、O原子有2对孤对电子对,杂化轨道数为4,O原子采取sp3杂化,
故答案为:SO42-; N、S、O;
(5)加热,NH3挥发,生成Cu(OH)2蓝色沉淀和(NH4)2SO4,
故答案为:加热,NH3挥发,生成Cu(OH)2蓝色沉淀和(NH4)2SO4.
点评 本题考查元素周期律、核外电子排布规律、晶体结构与化学键、平衡移动、杂化等,综合性较大,题目难度中等,是对所学知识的综合运用与学生能力的考查,会利用价层电子对互斥理论确定杂化类型是解答的重点,也是高频考点.

 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案| A. | 达到平衡后,这个反应就停止,正反应速率等于逆反应速率且为0 | |
| B. | 最终可生成0.2 mol NH3 | |
| C. | 升髙温度,反应速率增大 | |
| D. | 当V正(N2):V 正(H2)=1:3时,一定达化学平衡状态 |
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)═c(OH-)+c(A-) | |
| B. | 物质的量浓度相等的CH3COONa、NaOH和Na2CO3三种溶液:pH(NaOH)>pH(CH3COONa)>pH(Na2CO3) | |
| C. | NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-) | |
| D. | 10℃时pH=12的NaOH溶液与40℃时pH=12的NaOH溶液中c(OH-)相等 |
| A. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O | |
| B. | 淀粉碘化钾溶液在空气中变蓝:4I-+O2+2H2O=4OH-+2I2 | |
| C. | 磁性氧化铁溶于盐酸:Fe2O3+6H+=2Fe3++3H2O | |
| D. | 用氨水吸收足量的SO2气体:OH-+SO2=HSO3- |
| A. | 丙烷分子的比例模型示意图为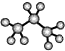 | |
| B. | 按系统命名法,(CH3)2CHCH(CH3)CH=CH2的名称为2,3-二甲基-4-戊烯 | |
| C. | 乙烯的结构简式:C2H4 | |
| D. | 乙醇的最简式:C2H6O |
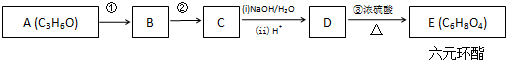
 +2H2O.
+2H2O.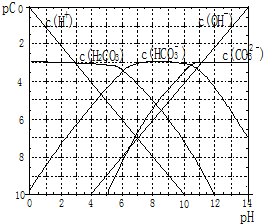 pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中该溶质的pC=-lg1×10-3=3.已知H2CO3溶液中存在的化学平衡为:CO2+H2O?H2CO3?H++HCO3-?2H++CO32-.如图为H2CO3溶液的pC-pH图.请回答下列问题:
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中该溶质的pC=-lg1×10-3=3.已知H2CO3溶液中存在的化学平衡为:CO2+H2O?H2CO3?H++HCO3-?2H++CO32-.如图为H2CO3溶液的pC-pH图.请回答下列问题: