题目内容
7.下列关于元素周期表的叙述,错误的是( )| A. | 镁是第IIA族元素 | |
| B. | 第IA族元素全部是金属元素 | |
| C. | 氧族中含金属元素 | |
| D. | 第3周期中既有金属元素又有非金属元素 |
分析 A、主族元素最外层电子数等于主族序数;
B、氢是非金属;
C、84号元素钋是金属;
D、钠、镁、铝是金属,其余是非金属元素.
解答 解:A、主族元素最外层电子数等于主族序数,所以12号镁最外层2个电子,是第IIA族元素,故A正确;
B、氢是非金属,并不是全部是金属,故B错误;
C、84号元素钋是金属,故C正确;
D、钠、镁、铝是金属,其余是非金属元素,所以第3周期中既有金属元素又有非金属元素,故D正确;
故选B.
点评 本题考查元素周期表的结构及应用,为高频考点,把握短周期及原子结构中最外层电子数与族序数的关系为解答的关键,注重基础知识的考查,题目难度不大

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
4.下列说法不正确的是( )
| A. | 不能自发进行的氧化还原反应,也可以通过电解来实现 | |
| B. | 电解质溶液导电是化学变化,金属导电是物理变化 | |
| C. | 电解池和原电池中均发生氧化还原反应 | |
| D. | 电解、电离、原电池均需要通电 |
12.下列关于Cl2性质的说法正确的是( )
| A. | 密度比空气小 | B. | 是无色无味的气体 | ||
| C. | 能使干燥的有色布条褪色 | D. | 可与NaOH溶液反应 |
16.将0.1mol N2和0.3mol H2置于密闭容器中发生反应:N2+3H2$?_{催化剂}^{高温、高压}$2NH3,下列关于该反应的说法中正确的是( )
| A. | 达到平衡后,这个反应就停止,正反应速率等于逆反应速率且为0 | |
| B. | 最终可生成0.2 mol NH3 | |
| C. | 升髙温度,反应速率增大 | |
| D. | 当V正(N2):V 正(H2)=1:3时,一定达化学平衡状态 |

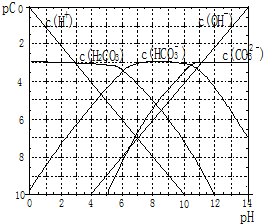 pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中该溶质的pC=-lg1×10-3=3.已知H2CO3溶液中存在的化学平衡为:CO2+H2O?H2CO3?H++HCO3-?2H++CO32-.如图为H2CO3溶液的pC-pH图.请回答下列问题:
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中该溶质的pC=-lg1×10-3=3.已知H2CO3溶液中存在的化学平衡为:CO2+H2O?H2CO3?H++HCO3-?2H++CO32-.如图为H2CO3溶液的pC-pH图.请回答下列问题: