题目内容
9.若在25℃时,pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,恰好完全反应.(1)混合液中A-水解常数的表达式为Kh=$\frac{[HA]•[O{H}^{-}]}{[{A}^{-}]}$.
(2)计算该温度下醋酸的电离常数(用含a、b的式子表示)为$\frac{1{0}^{-2b}}{1{0}^{a-14}-1{0}^{-b}}$.
分析 (1)据A-水解方程式书写水解平衡常数;
(2)醋酸的电离常数K=$\frac{[C{H}_{3}CO{O}^{-}]•[{H}^{+}]}{[C{H}_{3}COOH]}$,c(醋酸)=c(NaOH),氢离子浓度已知,则可以计算出K.
解答 解:(1)A-水解方程式位A-+H2O?HA+OH-,其水解平衡常数表达式为Kh=$\frac{[HA]•[O{H}^{-}]}{[{A}^{-}]}$,故答案为:$\frac{[HA]•[O{H}^{-}]}{[{A}^{-}]}$;
(2)c(醋酸)=c(NaOH)=10a-14mol/L,c(H+)=c(CH3COO-)=10-bmol/L,则醋酸的电离常数K=$\frac{[C{H}_{3}CO{O}^{-}]•[{H}^{+}]}{[C{H}_{3}COOH]}$=$\frac{1{0}^{-b}•1{0}^{-b}}{1{0}^{a-14}-1{0}^{-b}}$=$\frac{1{0}^{-2b}}{1{0}^{a-14}-1{0}^{-b}}$;
故答案为:$\frac{1{0}^{-2b}}{1{0}^{a-14}-1{0}^{-b}}$.
点评 本题考查了酸碱混合溶液的有关计算,难度不大,侧重于考查学生对知识的综合应用能力和数据处理能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.铁棒和石墨棒用导线连接后,浸入0.01mol/L 的氯化钠溶液中,下列说法正确的是( )
| A. | 铁棒附近产生OH- | B. | 铁棒质量减少 | ||
| C. | 石墨棒上放出氯气 | D. | 石墨棒上放出氧气 |
1.在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:
2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H=-92.3KJ/mol
反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为101KPa):
回答下列问题:
①3~4min和7~9min时段,反应处于平衡状态.
②第5min时,从同时提高速率和转化率两个方面分析,改变的外界条件是增大压强,平衡向正方向移动.
2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H=-92.3KJ/mol
反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为101KPa):
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
①3~4min和7~9min时段,反应处于平衡状态.
②第5min时,从同时提高速率和转化率两个方面分析,改变的外界条件是增大压强,平衡向正方向移动.
18.下列说法中正确的是( )
| A. | 丙烷分子的比例模型示意图为 | |
| B. | 按系统命名法,(CH3)2CHCH(CH3)CH=CH2的名称为2,3-二甲基-4-戊烯 | |
| C. | 乙烯的结构简式:C2H4 | |
| D. | 乙醇的最简式:C2H6O |
19.下列各组物质性质的比较中,不正确的是( )
| A. | 热稳定性SiH4<PH3<NH3<H2O | B. | 熔点:Na>K>Rb>Cs | ||
| C. | 酸性:H2CO3<H3PO4<H2SO4<HClO4 | D. | 半径:K+>Na+>O2->F- |
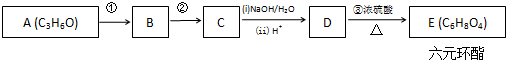
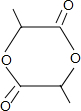 +2H2O.
+2H2O.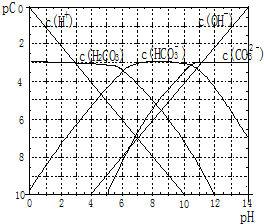 pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中该溶质的pC=-lg1×10-3=3.已知H2CO3溶液中存在的化学平衡为:CO2+H2O?H2CO3?H++HCO3-?2H++CO32-.如图为H2CO3溶液的pC-pH图.请回答下列问题:
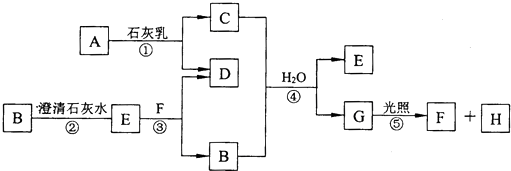
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中该溶质的pC=-lg1×10-3=3.已知H2CO3溶液中存在的化学平衡为:CO2+H2O?H2CO3?H++HCO3-?2H++CO32-.如图为H2CO3溶液的pC-pH图.请回答下列问题: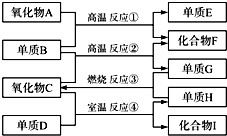 已知:①单质E可作为半导体材料;②化合物F是不能生成盐的氧化物;③化合物I能溶于水呈酸性,它能够跟氧化物A起反应.据此,请填空:
已知:①单质E可作为半导体材料;②化合物F是不能生成盐的氧化物;③化合物I能溶于水呈酸性,它能够跟氧化物A起反应.据此,请填空: