题目内容
12.氮元素可形成卤化物、叠氮化物及络合物.(1)NF3构型为三角锥体,沸点为-129℃,可在铜催化作用下由F2和过量NH3反应得到,NF3属于分子晶体,写出制备NF3的化学反应方程式:4NH3+3F2$\frac{\underline{\;铜\;}}{\;}$NF3+3NH4F;
(2)氢叠氮酸(HN4)是一种弱酸,它的酸性类似于醋酸,微弱电离出H+和N3-.
①与N3-互为等电子体的分子、离子有N2O或CO2或CS2或BeCl2、SCN-或OCN-或CNO-(各举1例),由此可推知N3-的空间构型是直线型;
②叠氮化物、氯化物能与Fe3+及Cu2+及Co3+等形成络合物,如:[Co(N3)(NH3)3]SO4、Fe(CH)64-,写出钴原子在基态时的价电子排布式:3d 74s2;:[Co(N3)(NH3)3]SO4中钴的配位数为6,CN-中C原子的杂化类型是sp.
分析 (1)根据沸点判断晶体类型;根据反应物、生成物、反应条件写相应的方程式;
(2)①根据等电子体的定义分析;根据空间构型的判断方法判断;
②根据基态原子的价电子排布式书写规则书写;根据配位数的判断方法判断;根据杂化类型的判断方法判断;
解答 解:(1)NF3的沸点较低,所以是分子晶体;在铜催化作用下由F2和过量NH3反应生成NF3和NH4F,所以反应方程式为:
4NH3+3F2$\frac{\underline{\;铜\;}}{\;}$NF3+3NH4F,故答案为:分子;4NH3+3F2$\frac{\underline{\;铜\;}}{\;}$NF3+3NH4F;
(2)①N3-含有三个原子22个电子,与其等电子体的分子有N2O或CO2或CS2或BeCl2,与其等电子体的离子有 SCN-或OCN-或CNO;N3-与CO2是等电子体,具有相同的价电子数,它们具有相似的化学结构,二氧化碳是直线型分子,所以N3-的空间构型是直线型.
故答案为:N2O或CO2或CS2或BeCl2; SCN-或OCN-或CNO-;直线;
②钴是37号元素,其基态原子核外电子排布式为[Ar]3d74s2,所以其原子在基态时的价电子排布式为3d 74s2;
其配位数是1+5=6;CN-中价层电子对数=1+$\frac{1}{2}$=2,所以采取sp杂化.
故答案为:3d 74s2;6;sp;
点评 本题考查了配位数、分子的空间构型等知识点,分子的空间构型、分子中原子的杂化类型的判断是每年高考的热点,对此知识点一定掌握;元素第一电离能的规律中,要注意异常现象并会解释原因.

练习册系列答案
相关题目
3.下列溶液中有关物质的量浓度关系正确的是( )
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)═c(OH-)+c(A-) | |
| B. | 物质的量浓度相等的CH3COONa、NaOH和Na2CO3三种溶液:pH(NaOH)>pH(CH3COONa)>pH(Na2CO3) | |
| C. | NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-) | |
| D. | 10℃时pH=12的NaOH溶液与40℃时pH=12的NaOH溶液中c(OH-)相等 |
7.25℃的四种溶液:
①pH=2的CH3COOH溶液②pH=2的HCl溶液③pH=12的氨水④pH=12的NaOH溶液,
有关上述溶液的说法,正确的是( )
①pH=2的CH3COOH溶液②pH=2的HCl溶液③pH=12的氨水④pH=12的NaOH溶液,
有关上述溶液的说法,正确的是( )
| A. | ①、④溶液中水电离的c( H+):①>④ | |
| B. | 将②、③溶液混合后pH=7,则消耗溶液的体积:②<③ | |
| C. | 将①、④溶液混合后pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7mol•L-1 | |
| D. | 分别向等体积的上述溶液中加入100 mL,水,溶液的pH:③>④>①>② |
1.在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:
2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H=-92.3KJ/mol
反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为101KPa):
回答下列问题:
①3~4min和7~9min时段,反应处于平衡状态.
②第5min时,从同时提高速率和转化率两个方面分析,改变的外界条件是增大压强,平衡向正方向移动.
2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H=-92.3KJ/mol
反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为101KPa):
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
①3~4min和7~9min时段,反应处于平衡状态.
②第5min时,从同时提高速率和转化率两个方面分析,改变的外界条件是增大压强,平衡向正方向移动.
2.超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)前2s内的平均反应速率v(N2)=1.88×10-4mol•L-1•S-1.
(2)在该温度下,反应的平衡常数K=5000 L•mol-1.
(3)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
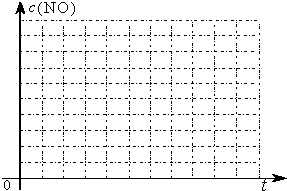
①请在上表空格中填入剩余的实验条件数据.
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号.
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)前2s内的平均反应速率v(N2)=1.88×10-4mol•L-1•S-1.
(2)在该温度下,反应的平衡常数K=5000 L•mol-1.
(3)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
| 实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号.


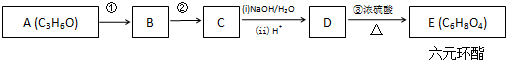
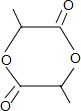 +2H2O.
+2H2O.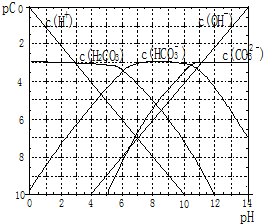 pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中该溶质的pC=-lg1×10-3=3.已知H2CO3溶液中存在的化学平衡为:CO2+H2O?H2CO3?H++HCO3-?2H++CO32-.如图为H2CO3溶液的pC-pH图.请回答下列问题:
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中该溶质的pC=-lg1×10-3=3.已知H2CO3溶液中存在的化学平衡为:CO2+H2O?H2CO3?H++HCO3-?2H++CO32-.如图为H2CO3溶液的pC-pH图.请回答下列问题: 已知:①单质E可作为半导体材料;②化合物F是不能生成盐的氧化物;③化合物I能溶于水呈酸性,它能够跟氧化物A起反应.据此,请填空:
已知:①单质E可作为半导体材料;②化合物F是不能生成盐的氧化物;③化合物I能溶于水呈酸性,它能够跟氧化物A起反应.据此,请填空: