题目内容
12.X、Y、Z、W四种短周期元素在元素周期表中的相对位置如表所示,Z的单质是常见的半导体材料.下列说法正确的是( )| X | ||
| Y | Z | W |
| A. | X、Z、W的简单氢化物的稳定性Z>W>X | |
| B. | X元素的单质在化学反应中只表现还原性 | |
| C. | X、Y的简单离子半径Y>X | |
| D. | Y、Z、X的最高价氧化物均能与NaOH溶液反应 |
分析 X、Y、Z、W四种短周期元素中,Z的单质是常见的半导体材料,则Z为Si,由元素在元素周期表中的相对位置,可知X为N元素、Y为Al、W为P元素.
A.非金属性越强,氢化物越稳定;
B.氮气中N元素化合价为0,反应中化合价可以升高,也可以降低;
C.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
D.Y、Z、X的最高价氧化物分别为氧化铝、二氧化硅、五氧化二氮,均能与NaOH溶液反应.
解答 解:X、Y、Z、W四种短周期元素中,Z的单质是常见的半导体材料,则Z为Si,由元素在元素周期表中的相对位置,可知X为N元素、Y为Al、W为P元素.
A.同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故非金属性Z<W<X,非金属性越强,氢化物越稳定,简单氢化物的稳定性Z<W<X,故A错误;
B.氮气中N元素化合价为0,反应中化合价可以升高,也可以降低,如与氧气反应生成NO,表现还原性,与氢气生成氨气,表现氧化性,故B错误;
C.N3-、Al3+电子层结构相同,核电荷数越大离子半径越小,故离子半径:N3->Al3+,故C错误;
D.Y、Z、X的最高价氧化物分别为氧化铝、二氧化硅、五氧化二氮,氧化铝属于两性氧化物,能与NaOH溶液反应,二氧化硅、五氧化二氮属于酸性氧化物,能与氢氧化钠溶液反应,故D正确,
故选D.
点评 本题考查物质结构性质关系,推断元素是解题关键,注意对元素周期律的理解掌握,掌握微粒半径比较规律,难度不大.

练习册系列答案
相关题目
3.“莫斯科2009年7月28日电,27日夜间,位于莫斯科郊外的杜伯纳国际联合核研究所的专家们启动新元素合成实验,如果顺利的话,实验结束时将会合成门捷列夫元素周期表上的第117号新元素”.下列有关该元素的说法正确的是( )
| A. | 117 g该元素原子的物质的量为1 mol | |
| B. | 该元素一定为非金属元素 | |
| C. | 该元素在地球上的含量十分丰富 | |
| D. | 该元素的金属性可能比非金属性更明显 |
17.下列有关化学用语或名称表达正确的是( )
| A. | 聚丙烯的结构简式: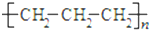 | |
| B. | 乙炔的分子结构模型示意图: | |
| C. | H2O2的电子式:H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-H+ | |
| D. |  的名称:3-甲基-1-丁醇 的名称:3-甲基-1-丁醇 |
2.如图所示信息判断,下列离子能够大量共存的一组是( )
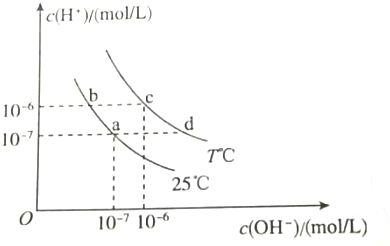

| A. | a点对应的溶液中:Al3+、Na+、Cl-、CO32- | |
| B. | b点对应的溶液中:K+、Ba2+、NO3-、AlO2- | |
| C. | c点对应的溶液中:Fe3+、Na+、I-、SO42- | |
| D. | d点对应的溶液中:Na+、K+、SO32-、Cl- |
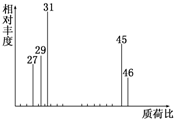 为了测定某有机物A的结构,做如下实验:
为了测定某有机物A的结构,做如下实验: .根据下列转化流程,回答问题:
.根据下列转化流程,回答问题: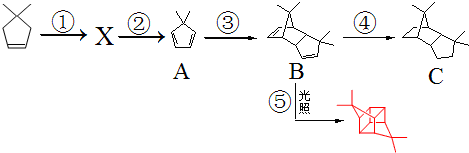
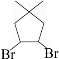 .
. 的合成路线:
的合成路线: )
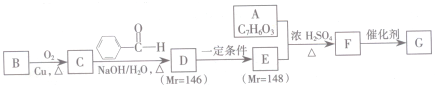
)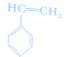 $\stackrel{Br_{2}}{→}$
$\stackrel{Br_{2}}{→}$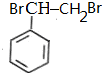 $→_{△}^{NaOH溶液}$
$→_{△}^{NaOH溶液}$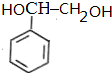 $\stackrel{[O]}{→}$
$\stackrel{[O]}{→}$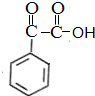 $→_{催化剂}^{H_{2}}$
$→_{催化剂}^{H_{2}}$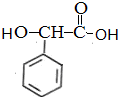 $\stackrel{浓H_{2}SO_{4}△}{→}$
$\stackrel{浓H_{2}SO_{4}△}{→}$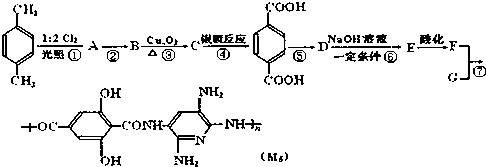
 ,
, ;F的含氧官能团的名称有羧基、(酚)羟基.
;F的含氧官能团的名称有羧基、(酚)羟基. .
.

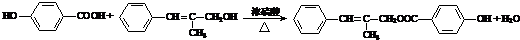 .
. .
. (其中任一种).
(其中任一种).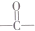 结构②苯环上有2个取代基.
结构②苯环上有2个取代基.