题目内容
20.碳碳双键的性质较为活泼,在一定条件下会发生特殊的反应,例如: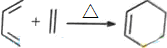 .根据下列转化流程,回答问题:
.根据下列转化流程,回答问题: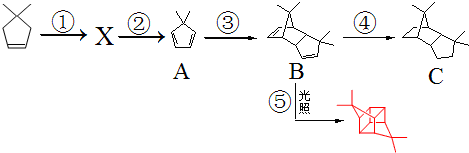
(1)反应条件:②NaOH醇溶液,加热,③加热.
(2)反应类型:①加成,⑤加成.
(3)结构简式:X
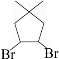 .
.(4)写出实验室由B的芳香烃的同分异构体的同系物制备
 的合成路线:
的合成路线:(合成路线常用的表示方式为:
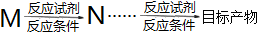 )
) $\stackrel{Br_{2}}{→}$
$\stackrel{Br_{2}}{→}$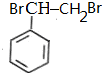 $→_{△}^{NaOH溶液}$
$→_{△}^{NaOH溶液}$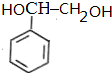 $\stackrel{[O]}{→}$
$\stackrel{[O]}{→}$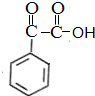 $→_{催化剂}^{H_{2}}$
$→_{催化剂}^{H_{2}}$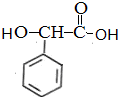 $\stackrel{浓H_{2}SO_{4}△}{→}$
$\stackrel{浓H_{2}SO_{4}△}{→}$ .
.
分析 根据题中各物质转化关系,比较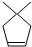 和A的结构简式可知,
和A的结构简式可知, 与溴加成生成X为
与溴加成生成X为 ,X在氢氧化钠醇溶液中加热发生消去反应生成A,A发生题中信息中的加成反应生成B,反应条件为加热,B再与氢气发生加成得C,B发生分子内加成得
,X在氢氧化钠醇溶液中加热发生消去反应生成A,A发生题中信息中的加成反应生成B,反应条件为加热,B再与氢气发生加成得C,B发生分子内加成得 ,制备
,制备 ,可以用B的芳香烃的同分异构体的同系物为
,可以用B的芳香烃的同分异构体的同系物为 ,由苯乙烯与溴加成,再水解得二元醇,再氧化得
,由苯乙烯与溴加成,再水解得二元醇,再氧化得 ,
, 与氢气加成得
与氢气加成得 ,再发生加聚反应得
,再发生加聚反应得 ,据此答题;
,据此答题;
解答 解:根据题中各物质转化关系,比较 和A的结构简式可知,
和A的结构简式可知, 与溴加成生成X为
与溴加成生成X为 ,X在氢氧化钠醇溶液中加热发生消去反应生成A,A发生题中信息中的加成反应生成B,反应条件为加热,B再与氢气发生加成得C,B发生分子内加成得
,X在氢氧化钠醇溶液中加热发生消去反应生成A,A发生题中信息中的加成反应生成B,反应条件为加热,B再与氢气发生加成得C,B发生分子内加成得 ,
,
(1)根据上面的分析可知,反应②的条件为NaOH醇溶液,加热,反应③的条件为加热,
故答案为:NaOH醇溶液,加热; 加热;
(2)根据上面的分析可知,反应①为加成反应,反应⑤为加成反应,
故答案为:加成;加成;
(3)X为 ,
,
故答案为: ;
;
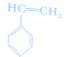
(4)制备 ,可以用B的芳香烃的同分异构体的同系物为
,可以用B的芳香烃的同分异构体的同系物为 ,由苯乙烯与溴加成,再水解得二元醇,再氧化得
,由苯乙烯与溴加成,再水解得二元醇,再氧化得 ,
, 与氢气加成得
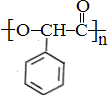
与氢气加成得 ,再发生加聚反应得
,再发生加聚反应得 ,合成路线为
,合成路线为 $\stackrel{Br_{2}}{→}$
$\stackrel{Br_{2}}{→}$ $→_{△}^{NaOH溶液}$
$→_{△}^{NaOH溶液}$ $\stackrel{[O]}{→}$
$\stackrel{[O]}{→}$ $→_{催化剂}^{H_{2}}$
$→_{催化剂}^{H_{2}}$ $\stackrel{浓H_{2}SO_{4}△}{→}$
$\stackrel{浓H_{2}SO_{4}△}{→}$ ,
,
故答案为: $\stackrel{Br_{2}}{→}$
$\stackrel{Br_{2}}{→}$ $→_{△}^{NaOH溶液}$
$→_{△}^{NaOH溶液}$ $\stackrel{[O]}{→}$
$\stackrel{[O]}{→}$ $→_{催化剂}^{H_{2}}$
$→_{催化剂}^{H_{2}}$ $\stackrel{浓H_{2}SO_{4}△}{→}$
$\stackrel{浓H_{2}SO_{4}△}{→}$ .
.
点评 本题考查有机物推断与合成,侧重考查分析、推断、知识迁移能力,答题时注意结合题给信息解答,有机合成是本题的难点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.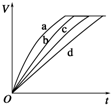 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体
积V的数据,根据数据绘制得到图,则曲线a、b、c、d所对应的实验组别可能是( )
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到图,则曲线a、b、c、d所对应的实验组别可能是( )
| 组别 | c(HCl)/(mol•L-1) | 温度/(℃) | 状态 |
| 1 | 2.0 | 30 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.0 | 20 | 块状 |
| 4 | 2.5 | 30 | 粉末状 |
| A. | 4、3、2、1 | B. | 4、2、1、3 | C. | 3、4、2、1 | D. | 4、1、2、3 |
11.如表是部分短周期元素原子半径及主要化合价,根据表中信息,判断以下叙述不正确的是( )
| 元素代号 | K | L | M | Q | R | T | N |
| 原子半径/nm | 0.183 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | +2 | -2 | +1 |
| A. | K、L、M三种元素的金属性逐渐减弱 | |
| B. | 在RCl2分子中,各原子均满足8电子的稳定结构 | |
| C. | Q元素的最高价氧化物为非电解质,其水溶液能够导电 | |
| D. | K在T单质中燃烧所形成的化合物中含有非极性共价键和离子键 |
8. 当今世界,能源的发展日益成为全世界、全人类共同关心的问题.
当今世界,能源的发展日益成为全世界、全人类共同关心的问题.
(1)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如表所示:
①请根据上述信息,写出A的核外电子排布式:1s22s2.
②某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背了能量最低原理.
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.
①已知金刚石中碳碳键的键长为154.45pm,C60中碳碳键的键长为145pm和140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由否或不正确,理由:C60是分子晶体,金刚石是原子晶体,熔化时C60破坏分子间作用力而金刚石破坏共价键,所以C60的沸点低于金刚石.
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.该物质中K原子和C60分子的个数比为3:1.
③继C60后,科学家又合成Si60、N60,请比较C、Si、N原子电负性由大到小的顺序N>C>Si.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则一个Si60分子中所含π键的数目为30.
 当今世界,能源的发展日益成为全世界、全人类共同关心的问题.
当今世界,能源的发展日益成为全世界、全人类共同关心的问题.(1)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 899 | 1 757 | 14 840 | 21 000 |
| B | 738 | 1 451 | 7 733 | 10 540 |
②某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背了能量最低原理.
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.
①已知金刚石中碳碳键的键长为154.45pm,C60中碳碳键的键长为145pm和140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由否或不正确,理由:C60是分子晶体,金刚石是原子晶体,熔化时C60破坏分子间作用力而金刚石破坏共价键,所以C60的沸点低于金刚石.
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.该物质中K原子和C60分子的个数比为3:1.
③继C60后,科学家又合成Si60、N60,请比较C、Si、N原子电负性由大到小的顺序N>C>Si.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则一个Si60分子中所含π键的数目为30.
15.下列各实验中,有关浓盐酸作用的表述错误的是( )
| A. | 配制CuCl2溶液时,将CuCl2(s)溶于浓HCl后再加水冲稀,浓盐酸作用:有利于抑制CuCl2水解,可防止Cu(OH)2的形成 | |
| B. | 加热MnO2的浓HCl溶液制取氯气.浓盐酸作用:有利于减少氯气的溶解损失 | |
| C. | 浓硝酸不能溶解金,需用浓HCl溶液配制王水才能溶解金.浓盐酸作用:有利于增强Au的还原性,并且提高硝酸的氧化性 | |
| D. | 将浓硫酸滴入浓盐酸中制备HCl气体.浓盐酸作用:增大溶质的浓度,有利于促进平衡向气体溶解的逆方向移动 |
5.对表中有关离子方程式书写评价合理的是( )
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | Fe3O4与过量稀硝酸反应:Fe3O4+8H+→2Fe3++Fe2++4H2O | 正确 |
| B | 在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液: 2Fe3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Fe(OH)3↓ | 正确 |
| C | 在稀氨水中通入过量CO2:NH3•H2O+CO2→NH4++HCO3- | 正确 |
| D | FeBr2溶液与等物质的量的Cl2反应: 2Fe2++2Br-+2Cl2→2Fe3++4Cl-+Br2 | 错误,Fe2+与Br-的化学计量数之比应为1:2 |
| A. | A | B. | B | C. | C | D. | D |
12.X、Y、Z、W四种短周期元素在元素周期表中的相对位置如表所示,Z的单质是常见的半导体材料.下列说法正确的是( )
| X | ||
| Y | Z | W |
| A. | X、Z、W的简单氢化物的稳定性Z>W>X | |
| B. | X元素的单质在化学反应中只表现还原性 | |
| C. | X、Y的简单离子半径Y>X | |
| D. | Y、Z、X的最高价氧化物均能与NaOH溶液反应 |
9.A、B、C、D、E是中学化学中五种常见元素,有关信息如表:
请回答下列问题:
(1)A的氢化物分子式是NH3,其水溶液能使酚酞变红的原因(用电离方程式解释)为:NH3•H2O?NH4++OH-;
(2)A、D的氢化物相互反应,产生大量白烟,该反应的方程式为:NH3+HCl=NH4Cl;
(3)A与B可组成质量比为7:16的三原子分子,该分子的化学式为NO2.
| 元素 | 有关信息 |
| A | 其氢化物水溶液呈碱性 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)A的氢化物分子式是NH3,其水溶液能使酚酞变红的原因(用电离方程式解释)为:NH3•H2O?NH4++OH-;
(2)A、D的氢化物相互反应,产生大量白烟,该反应的方程式为:NH3+HCl=NH4Cl;
(3)A与B可组成质量比为7:16的三原子分子,该分子的化学式为NO2.
10.铜有两种天然同位素,则${\;}_{29}^{63}$Cu+和${\;}_{29}^{65}$Cu具有相同的( )
| A. | 质量数 | B. | 中子数 | C. | 核电荷数 | D. | 能层和能级 |