题目内容
3.现有下列七种物质:①铝 ②蔗糖 ③CO2 ④H2SO4 ⑤Ba(OH)2⑥红褐色的氢氧化铁胶体 ⑦HCl
(1)上述物质中属于电解质的有④⑤⑦非电解质的有②③ (填序号)
(2)向⑥的溶液中逐渐滴加⑦的溶液,看到的现象是先有红褐色沉淀产生,后沉淀逐渐溶解.
(3)上述物质中有两种物质在水溶液中发生反应,其离子方程式为:H++OH-═H2O,则该反应的化学方程式为Ba(OH)2+2HCl═BaCl2+2H2O.
分析 (1)电解质:在水溶液中或熔融状态下能够导电的化合物;
非电解质:在熔融状态和水溶液中都不能导电的化合物;
(2)根据氢氧化铁胶体的性质进行判断;
(3)根据离子反应的实质进行书写.
解答 解:(1)①铝为金属单质,既不是电解质也不是非电解质;
②蔗糖在熔融状态和水溶液中都不能导电,是非电解质;
③CO2自身不能电离,是非电解质;
④H2SO4在水溶液中能导电,是电解质;
⑤Ba(OH)2在熔融状态下能导电,是电解质;
⑥红褐色的氢氧化铁胶体是混合物,既不是电解质也不是非电解质;
⑦HCl在水溶液中能导电,是电解质;
故属于电解质的是:④⑤⑦,非电解质的有②③;
故答案为:④⑤⑦;②③;
(2)盐酸是电解质溶液,氢氧化铁胶体遇到盐酸,胶体发生聚沉,生成氢氧化铁沉淀;再滴加盐酸,氢氧化铁沉淀与盐酸反应生成氯化铁,故现象为:先有红褐色沉淀产生,后沉淀逐渐溶解,
故答案为:先有红褐色沉淀产生,后沉淀逐渐溶解;
(3)离子反应H++OH-=H2O代表强酸和强碱反应生成可溶性的盐和水的反应,符合条件的该反应为Ba(OH)2+2HCl═BaCl2+2H2O,
故答案为:Ba(OH)2+2HCl═BaCl2+2H2O.
点评 本题考查电解质与非电解质的判断、胶体的性质、离子方程式的书写等,题目难度中等,注意掌握离子方程式的书写原则,明确电解质与非电解质的概念及区别.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
15. 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
I.该同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.请你设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是NaOH溶液,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子为:H++OH-═H2O.
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方为NH4++OH-═NH3•H2O.
(3)当c=13mL时,原溶液中Fe3+与Al3+的物质的量之比为2:1.
 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子为:H++OH-═H2O.
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方为NH4++OH-═NH3•H2O.
(3)当c=13mL时,原溶液中Fe3+与Al3+的物质的量之比为2:1.
3.下列实验操作中错误的是( )
| A. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| D. | 萃取操作时,应选择有机萃取剂 |
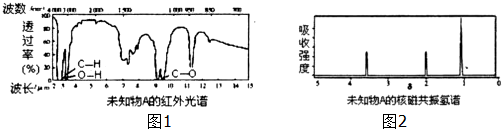
 =CHCOOCH2CH3)的路线如下:
=CHCOOCH2CH3)的路线如下:
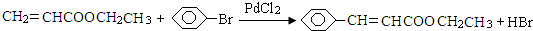


 )与化合物DCH3COOCH2CH3发生反应,可直接合成有机物Q.则D的结构简式为CH3COOCH2CH3,化合物C名称为苯甲醛.
)与化合物DCH3COOCH2CH3发生反应,可直接合成有机物Q.则D的结构简式为CH3COOCH2CH3,化合物C名称为苯甲醛. 今有碱金属的两种碳酸盐和碱土金属(第二主族)的一种不溶性碳酸盐组成的混合物,取其7.560g与过量盐酸完全反应,放出CO2体积为1.344L(标况下)另取等质量的原混合物,加水搅拌,可滤出不溶性盐1.420g.
今有碱金属的两种碳酸盐和碱土金属(第二主族)的一种不溶性碳酸盐组成的混合物,取其7.560g与过量盐酸完全反应,放出CO2体积为1.344L(标况下)另取等质量的原混合物,加水搅拌,可滤出不溶性盐1.420g.
 ,含有离子键和共价键(填化学键类型),属于离子化合物 (填“离子化合物”或“共价化合物”)
,含有离子键和共价键(填化学键类型),属于离子化合物 (填“离子化合物”或“共价化合物”)