题目内容
15.能影响水的电离平衡,并使溶液中c(H+)>c(OH-)的操作是( )| A. | 向水中投入一小块金属钠 | B. | 将水加热煮沸 | ||
| C. | 向水中加入CH3COONa晶体 | D. | 向水中加入NH4Cl溶液 |
分析 酸或碱抑制水电离,含有弱离子的盐因为水解而促进水电离,所以酸、碱或含有弱离子的盐都影响水的电离,溶液中的c(H+)>c(OH-)说明最终得到的溶液呈酸性,据此分析解答.
解答 解:A、加入金属钠,和水电离出的氢离子反应生成氢氧化钠和氢气,氢离子浓度降低,使水的电离向右移动,碱性增强,c(H+)<c(OH-),故A错误;
B、加热时促进水的电离,但是氢离子和氢氧根浓度依然相等,溶液仍然呈中性,故B错误;
C、向水中加入醋酸钠晶体,醋酸钠溶于水溶液中碳酸根离子水解显碱性,溶液中的c(H+)<c(OH-),对水的电离起促进作用,故C错误;
D、向水中加入氯化铵晶体溶解后溶液中铵根离子水解显酸性,溶液中的c(H+)>c(OH-),酸对水的电离起促进作用,故D正确,故选D.
点评 本题考查水电离的影响因素及溶液酸碱性判断,明确水的电离特点确定影响水电离的物质,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
5.位于三个周期的短周期元素X、Y、Z、M、N的原子序数依次增大,又知Y原子的最外层电子数是其内层电子数的3倍,M原子的最外层上只有2个电子,Z与X位于同一主族,N与Y位于同一主族.下列叙述正确的是( )
| A. | 原子半径:r(Z)>r(M)>r(N)>r(Y)>r(X) | B. | 元素的负电性:Y>N>X>Z | ||
| C. | 元素的第一电离能:I1(M)>I1(Z)>I1(X) | D. | 原子中的为成对电子数:N>Y>Z>M |
6.长效阿司匹林的结构为: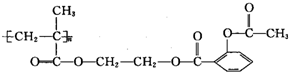 ,1mol该物质能与NaOH反应的物质的量是( )
,1mol该物质能与NaOH反应的物质的量是( )
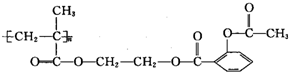 ,1mol该物质能与NaOH反应的物质的量是( )
,1mol该物质能与NaOH反应的物质的量是( )| A. | 3mol | B. | 4mol | C. | 3n mol | D. | 4n mol |
3.工业上冶炼金属钙可使用的方法是( )
| A. | 热分解法 | B. | 热还原法 | C. | 铝热剂法 | D. | 电解法 |
10.下列说法正确的是( )
| A. | 工业上可通过电解饱和食盐水制得金属钠 | |
| B. | 失去电子的物质是还原剂,还原剂发生氧化反应,表现出还原性 | |
| C. | 红热的铁丝在氯气中剧烈燃烧产生大量的白烟 | |
| D. | 干燥的氯气有漂白性,还能用作杀菌消毒剂 |
7.已知 A、B、C、D、E 是短周期中原子序数依次增大的 5种主族元素,其中元素 A、E 的单质在常温下呈气态,元素 B 的原子最外层电子数是其电子层数的 2 倍,元素 C 在同周期的主族元素中原子半径最大,元素 D 的单质是金属,它与冷水反应缓慢,与沸水反应迅速.下列说法正确的是( )
| A. | 元素 A、B 组成的化合物常温下一定呈气态 | |
| B. | 元素 D 的最高价氧化物对应的水化物不是两性化合物 | |
| C. | 元素 C 的最高价氧化物对应的水化物是弱碱 | |
| D. | 化合物 AE 与 CE 有相同类型的化学键 |
4.据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍.其电池反应为:2CH3OH+3O2+4OH-$?_{充电}^{放电}$2CO32-+6H2O,则下列说法错误的是( )
| A. | 放电时负极的电极反应为:CH3OH-6e-+8OH-═CO${\;}_{3}^{2-}$+6H2O | |
| B. | 充电时电解质溶液的pH逐渐增大 | |
| C. | 放电时CH3OH参与反应的电极为正极 | |
| D. | 充电时每生成1 mol CH3OH转移6 mol电子 |
5.在反应 3NO2+H2O→2HNO3+NO 中NO2的作用是( )
| A. | 氧化剂 | B. | 还原剂 | ||
| C. | 既是氧化剂又是还原剂 | D. | 既不是氧化剂又不是还原剂 |