题目内容
20.过碳酸钠(aNa2CO3•bH2O2)是一种新型氧系漂白剂,它集洗涤、消毒、供氧(有活性氧存在)于一体,无毒无味,漂白性能温和,无环境污染,广泛应用于洗涤、印染和医药等领域.已知:2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑
准确称取m1 g过碳酸钠样品配制成溶液,分为两等份.
(1)一份中滴加0.2000mol•L-1KMnO4溶液(已酸化)至恰好完全反应,消耗KMnO4溶液30.00mL,则m1 g样品中H原子的物质的量为0.06mol;
(2)另一份中滴加0.2000mol•L-1BaCl2溶液50.00mL恰好使碳酸根离子沉淀完全(仅考虑Ba2+与CO32-的反应).根据以上信息,确定过碳酸钠样品的化学式为2Na2CO3•3H2O2.
分析 (1)根据2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑,计算每一份中H2O2的物质的量,进而计算m1 g样品中H原子的物质的量;
(2)根据Na2CO3+BaCl2═BaCO3↓+2NaCl计算每一份中Na2CO3的物质的量,结合(1)中计算确定Na2CO3、H2O2的物质的量之比,进而确定过碳酸钠的化学式.
解答 解:(1)由2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑,可知每一份中H2O2的物质的量为$\frac{5}{2}$×0.03L×0.2mol/L=0.015mol,故m1 g样品中H原子的物质的量为0.015mol×2×2=0.06mol,
故答案为:0.06mol;
(2)由Na2CO3+BaCl2═BaCO3↓+2NaCl,可知每一份中n(Na2CO3)=n(BaCl2)=0.05L×0.2mol/L=0.01mol,Na2CO3、H2O2的物质的量之比为0.01mol:0.015mol=2:3,故过碳酸钠的化学式为2Na2CO3•3H2O2,
故答案为:2Na2CO3•3H2O2.
点评 本题考查化学方程式有关计算,比较基础,明确各个物理量之间的关系是解本题关键,侧重考查分析计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.将等质量的铜片在酒精灯上加热后,分别插入下列物质中,放置片刻,最终铜片质量减少的是( )
| A. | 盐酸 | B. | 无水乙醇 | C. | 石灰水 | D. | H2 |
11.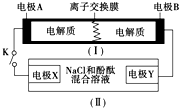 下图为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学反应方程式为:2K2S2+KI3 $?_{充电}^{放电}$K2S4+3KI.装置(Ⅱ)为电解池的示意图.当闭合开关K时,电极X附近溶液先变红.则闭合K时,下列说法正确的是( )
下图为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学反应方程式为:2K2S2+KI3 $?_{充电}^{放电}$K2S4+3KI.装置(Ⅱ)为电解池的示意图.当闭合开关K时,电极X附近溶液先变红.则闭合K时,下列说法正确的是( )
 下图为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学反应方程式为:2K2S2+KI3 $?_{充电}^{放电}$K2S4+3KI.装置(Ⅱ)为电解池的示意图.当闭合开关K时,电极X附近溶液先变红.则闭合K时,下列说法正确的是( )
下图为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学反应方程式为:2K2S2+KI3 $?_{充电}^{放电}$K2S4+3KI.装置(Ⅱ)为电解池的示意图.当闭合开关K时,电极X附近溶液先变红.则闭合K时,下列说法正确的是( )| A. | K+从左到右通过离子交换膜 | |
| B. | 电极A上发生的反应为:3I--2e-═I3- | |
| C. | 电极X上发生的反应为:2Cl--2e-═Cl2↑ | |
| D. | 当有0.1 mol K+通过离子交换膜,X电极上产生1.12 L气体 |
8.常温下,下列物质存放方法正确的是( )
| A. | 氢氧化钠溶液用带玻璃塞的玻璃瓶存放 | |
| B. | 金属钠保存在水中 | |
| C. | 浓硝酸存放于无色细口瓶中 | |
| D. | 浓硫酸贮存在铝制容器中 |
15.能影响水的电离平衡,并使溶液中c(H+)>c(OH-)的操作是( )
| A. | 向水中投入一小块金属钠 | B. | 将水加热煮沸 | ||
| C. | 向水中加入CH3COONa晶体 | D. | 向水中加入NH4Cl溶液 |
5.下列说法正确的是( )
| A. | 离子半径大小:F->Na+>Mg2+ | B. | 金属性强弱:K>Mg>Ca | ||
| C. | 酸性强弱:HIO4>HBrO4>HClO4 | D. | 碱性强弱:LiOH>NaOH>KOH? |
12.关于可逆反应达到平衡状态的说法错误的是( )
| A. | 达平衡时同一物质的V(正)=V(逆) | B. | 是动态平衡 | ||
| C. | 各组分的含量不随时间而变化 | D. | 外界条件不能改变平衡 |
9.下列说法中,正确的是( )
| A. | 1 mol H2SO4与1 molBa(OH)2反应生成H2O时放出的热叫做中和热 | |
| B. | △H>0 kJ•mol-1表示放热反应,△H<0 kJ•mol-1表示吸热反应 | |
| C. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| D. | 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
10.能够证明SO2中含有CO2的方法是将气体( )
| A. | 通入澄清石灰水 | |
| B. | 先通入酸性KMnO4溶液,再通入石灰水 | |
| C. | 通入品红溶液 | |
| D. | 先通入饱和NaHCO3溶液,在通入石灰水 |