题目内容
15.最近科学家提出一种“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为甲醇.其技术流程如下:
(1)吸收池中饱和碳酸钾溶液的作用是富集空气中的CO2;
(2)分解池中发生反应化学方程式为2KHCO3$\frac{\underline{\;\;△\;\;}}{\;}$K2CO3+CO2↑+H2O;
(3)合成塔中生成甲醇的反应,其原子利用率理论上否(能、否)达到100%.若合成塔中有2.2kg
CO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.47KJ/mol.
(4)如果空气不经过吸收池和分解池,而是直接通入合成塔,你认为不可以(填“可行”或“不可行”),理由是空气中的氧气和氢气混合加热或点燃可能发生爆炸.
(5)上述合成反应具有一定的可逆性,从平衡移动原理分析,低温有利于原料气的转化,而实际生产中采用
300°C的温度,其原因是提高催化剂的催化活性,加快反应速率.
(6)已知25℃时Ksp[Fe(OH)3]=2.8×10-39,则该温度下反应Fe3++3H2O?Fe(OH)3+3H+的平衡常数K=3.6×10-4 .
分析 把空气吹入碳酸钾溶液,碳酸钾会吸收空气中二氧化碳气体,得到碳酸氢钾溶液,在高温水蒸汽中碳酸氢钾分解生成碳酸钾,二氧化碳和水,目的是富集二氧化碳,进入合成塔,通入氢气在一定温度压强下反应生成甲醇;
(1)碳酸钾吸收空气中二氧化碳反应生成碳酸氢钾;
(2)分解池中是碳酸氢钾分解生成碳酸钾、二氧化碳和水;
(3)依据合成甲醇的反应产物分析判断原子利用率,原子利用率是指反应物中的所有原子进入期望产物中的百分比,反应达到完全转化,即100%转化为目标产物;
(4)空气中的氧气和氢气混合加热或点燃可能发生爆炸;
(5)依据影响反应速率的因素分析,此温度会提高反应速率,催化剂活性最大;
(6)Fe3++3H2O?Fe(OH)3+3H+,25℃时Ksp[Fe(OH)3]=2.8×10-39,Ksp=c(Fe3+)×c3(OH-),Kw=c(H+)×c(OH-),则K=$\frac{{c}^{3}({H}^{+})}{c(F{e}^{3+})}$=$\frac{(\frac{Kw}{c(O{H}^{-})})^{3}}{c(F{e}^{3+})}$=$\frac{K{w}^{3}}{Ksp}$.
解答 解:(1)碳酸钾能和二氧化碳反应生成碳酸氢钠,所以碳酸钾的作用是:吸收空气中二氧化碳,富集空气中的CO2,反应的化学方程式为:K2CO3+CO2+H2O=2KHCO3,
故答案为:富集空气中的CO2;
(2)在加热条件下,碳酸氢钾能分解生成碳酸钾、二氧化碳和水,化学方程式为:2KHCO3$\frac{\underline{\;\;△\;\;}}{\;}$K2CO3+CO2↑+H2O;
故答案为:2KHCO3$\frac{\underline{\;\;△\;\;}}{\;}$K2CO3+CO2↑+H2O;
(3)CO2与H2在300℃、2KPa的条件下生成水和甲醇,化学方程式为:CO2+3H2$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CH3OH,产物有甲醇、还有H2O,不符合转化率100%,若合成塔中有2.2kgCO2与足量H2恰好完全反应,可放出2473.5kJ的热量,1mol二氧化碳反应放热49.47KJ,写出合成塔中发生反应的热化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.47KJ/mol;
故答案为:否;CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.47KJ/mol;
(4)如果空气不经过吸收池和分解池,而是直接通入合成塔,空气中的氧气和氢气混合加热或点燃可能发生爆炸,引发危险,
故答案为:不可以;空气中的氧气和氢气混合加热或点燃可能发生爆炸,
(5)依据影响反应速率的因素分析,此温度会提高反应速率,催化剂活性最大,
故答案为:提高催化剂的催化活性,加快反应速率;
(6)Fe3++3H2O?Fe(OH)3+3H+,25℃时Ksp[Fe(OH)3]=2.8×10-39,Ksp=c(Fe3+)×c3(OH-),Kw=c(H+)×c(OH-),则K=$\frac{{c}^{3}({H}^{+})}{c(F{e}^{3+})}$=$\frac{(\frac{Kw}{c(O{H}^{-})})^{3}}{c(F{e}^{3+})}$=$\frac{K{w}^{3}}{Ksp}$=$\frac{(1{0}^{-14})^{3}}{2.8×1{0}^{-39}}$=3.6×10-4,
故答案为:3.6×10-4 .
点评 本题考查了甲醇的工业生产,主要考查物质的相互转化和制备的方法及注意事项,在解答时,首先分析题中的转化流程,然后结合学过的知识进行解答,题目难度中等.

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案| A. | 0.5 mol•L-1盐酸 | B. | 0.5 mol•L-1 KOH溶液 | ||
| C. | 0.5 mol•L-1醋酸 | D. | 0.5 mol•L-1Na2SO4 |

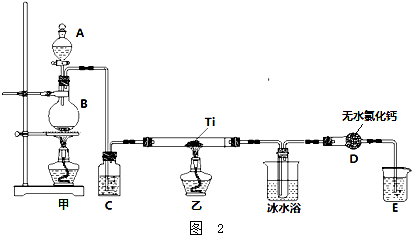
甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见表:
| 物质 | 沸点/℃ | 熔点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 甲醇 | 64.7 | / | 0.7915 | 易溶于水 |
| 乙醚 | 34.5 | / | 0.7138 | 微溶于水 |
| 3,5-二甲氧基苯酚 | / | 33~36 | / | 易溶于甲醇、乙醚,微溶于水 |
①分离出甲醇的操作是的蒸馏.
②萃取用到的分液漏斗使用前需检验漏并洗净,分液时有机层在分液漏斗的上填(“上”或“下”)层.
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是①除去HCl;用饱和食盐水洗涤的目的是②除去少量NaHCO3且减少产物损失.
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是dcab(填字母).
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)反应可能出现的副产物的结构简式为
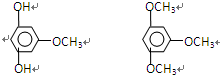 .
. 
反应物和产物的部分性质如表所示:
| 名称 | 分子量 | 性状 | 密度g/cm3 | 熔点℃ | 沸点℃ | 溶解度:克/100mL溶剂 | ||
| 水 | 醇 | 醚 | ||||||
| 苯甲醛 | 106 | 无色液体 | 1.06 | -26 | 178 | 0.3 | 互溶 | 互溶 |
| 乙酸酐 | 102 | 无色液体 | 1.082 | -73 | 138 | 12 | 溶 | 不溶 |
| 肉桂酸 | 148 | 无色固体 | 1.248 | 133 | 300 | 0.04 | 24 | 溶 |

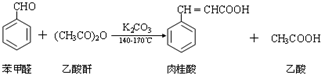
主要实验步骤:
Ⅰ合成:按图甲连接仪器,加入5mL苯甲醛、14mL乙酸酐和7.0g无水碳酸钾.再加入几粒固体X,控制温度在140~170℃,将此混合物回流45min.
Ⅱ分离与提纯:
①将上述合成的产品冷却后边搅拌边加入40mL水浸泡5分钟,并用水蒸气蒸馏,从混合物中除去未反应的苯甲醛,得到粗产品
②将上述粗产品冷却后加入40mL 10%的氢氧化钠水溶液,再加90mL水,加热活性炭脱色,趁热过滤、冷却;
③将1:1的盐酸在搅拌下加入到肉桂酸盐溶液中,至溶液呈酸性,经冷却、过滤、洗涤、
干燥等操作得到较纯净的肉桂酸4.5克;
请回答下列问题:
(1)固体X的作用是防止暴沸,X的名称是沸石或碎瓷片
(2)图甲装置中冷凝管的作用是冷凝回流,提高原料利用率,减少产物挥发
(3)图乙装置中玻璃管的作用是平衡压强,仪器D的名称是锥形瓶
(4)合成肉桂酸的实验需在无水条件下进行,实验前仪器必须干燥.实验中为控制温度在140~170℃需在BD中加热(请从下列选项中选择).
A.水 B.甘油(沸点290℃) C.砂子 D.植物油(沸点230~325℃)
(5)本实验中,肉桂酸的产率为60.8%.
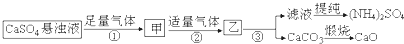
下列推断中正确的是( )
| A. | 步骤①和②中的气体属于可循环使用的气体 | |
| B. | 步骤②中发生的反应为:Ca2++CO2+2NH3•H2O═CaCO3↓+2NH4++H2O | |
| C. | 往甲中通CO2有利于(NH4)2SO4生成 | |
| D. | 以上涉及的化学反应中有氧化还原反应 |
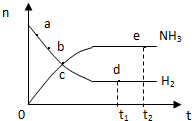
| A. | 点a处的正反应速率比点b处的大 | |
| B. | 点c处的正反应速率与逆反应速率相等 | |
| C. | 点d(t1时刻)的n(N2)比点e(t2时刻)处的n(N2)大 | |
| D. | 其他条件不变,773K下反应至t1时刻,此时画出的两根平行线间的距离将要变小 |
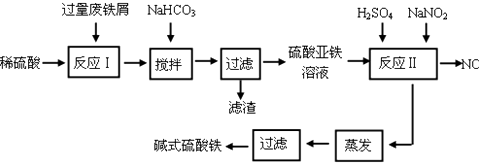
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)如何加快废铁屑的溶解,写出两种办法搅拌、加热.
(2)加入少量NaHCO3的目的是调节pH在4.4-7.5范围内.
(3)反应Ⅱ中加入NaNO2的目的是将亚铁离子氧化为铁离子.
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为C.
A.氯水 B.KSCN溶液 C.酸性KMnO4溶液 D.NaOH溶液
(6)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol/L Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.
已知:2Fe3++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-
则溶液中铁元素的总含量为g/L.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会偏高 (填“偏高”“偏低”“不变”).