题目内容
7.钛被称为“21世纪的金属”,其比强度位于金属之首.工业上常用金红石(主要成分TiO2)为主要原料制取金属钛及其化合物,如:TiCl3、TiO2.制取钛:①TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO ②2Mg+TiCl4$\frac{\underline{\;高温\;}}{\;}$ 2MgCl2+Ti③Ti+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4 ④TiCl4$\frac{\underline{\;高温\;}}{\;}$ 2Cl2↑+Ti铝还原法制取TiCl3:
(1)制取钛的反应②常在下列某气体中进行,该气体可以是d
a.空气 b.氮气 c.二氧化碳 d.氩气
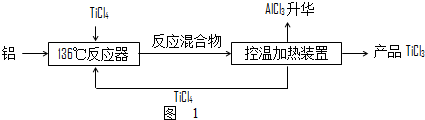
(2)TiCl4在工业生产中为重要的中间体,写出铝还原法制取TiCl3工艺中136℃反应器中的化学反应方程式4Al+3TiCl4$\frac{\underline{\;136℃\;}}{\;}$4AlCl3+3Ti
(3)TiCl4可用于制备TiO2,制备时向TiCl4中加入大量水并且加热可得TiO2•xH2O,写出该步反应的化学方程式TiCl4+(x+2)H2O$\frac{\underline{\;加热\;}}{\;}$TiO2•xH2O↓+4HCl↑
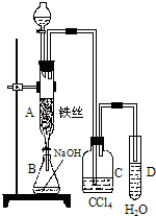
(4)实验室模拟反应③制TiCl4的装置如图2,已知:TiCl4在常温下为液体,空气中放置时就易水解,会产生刺激性烟雾.请回答:
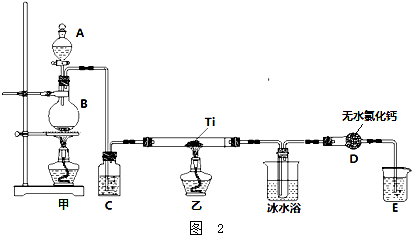
①仪器D的名称是球形干燥管
②仪器B中反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Cl2↑+Mn2++2H2O
③实验开始时先点燃甲(填“甲”或“乙”)处酒精灯.
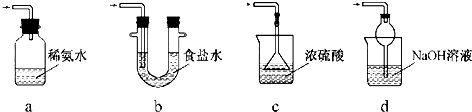
④装置C中盛装的液体是c,装置E中盛装的液体是d
a.水 b.饱和食盐水 c.浓硫酸 d.氢氧化钠溶液
⑤装置D的主要作用是防止水蒸汽进入造成产品水解.
分析 本题模拟工业上常用金红石(主要成分TiO2)为主要原料制取金属钛及其化合物TiCl3和TiO2,考查了反应原理及反应环境,如用热还原法利用镁制取Ti时要防镁的氧化,选择在惰性环境中进行,另外实验室制TiCl4时,结合TiCl4在常温下为液体,空气中放置时就易水解,会产生刺激性烟雾的性质,通入的氯气需经过干燥,并提供一个无氧环境,同时要注意尾气的处理,据此解答;
(1)选择反应②制取钛的环境时,只要考虑选择的气体不与镁参加反应即可;
(2)铝与TiCl4在136℃的条件下发生置换反应生成TiCl3;
(3)TiCl4在加热的条件下遇水水解可得TiO2•xH2O,同时生成HCl气体;
(4)①结合常见仪器的结构可确定D的名称;
②实验室利用二氧化锰和浓盐酸混合加热制氯气,发生反应的化学方程式为MnO2+4HCl$\frac{\underline{\;加热\;}}{\;}$Cl2↑+MnCl2+2H2O,据此可写出离子反应式;
③实验过程中要利用生成的氯气将装置内的空气排尽;
④为防止生成的TiCl4水解,氯气需要干燥,装置C应该是干燥作用,装置E是为了吸收含氯气的尾气,防止污染空气;
⑤装置D是一个干燥装置,防止外界的水汽进入TiCl4收集装置里.
解答 解:(1)在加热或点燃的情况下,镁能与氧气、二氧化碳和氮气反应,则选择氩气,故答案为:d;
(2)利用置换反应的原理用铝与TiCl4反应制得TiCl3,反应的方程式为4Al+3TiCl4$\frac{\underline{\;136℃\;}}{\;}$4AlCl3+3Ti,故答案为:4Al+3TiCl4$\frac{\underline{\;136℃\;}}{\;}$4AlCl3+3Ti;
(3)在加热的条件下,TiCl4水解得TiO2•xH2O和HCl,反应方程式为TiCl4+(x+2)H2O$\frac{\underline{\;加热\;}}{\;}$TiO2•xH2O↓+4HCl↑,故答案为:TiCl4+(x+2)H2O$\frac{\underline{\;加热\;}}{\;}$TiO2•xH2O↓+4HCl↑;
(4)①仪器D为球形干燥管,故答案为:球形干燥管;
②根据反应方程式MnO2+4HCl$\frac{\underline{\;加热\;}}{\;}$Cl2↑+MnCl2+2H2O可得实验室制氯气的离子反应式MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Cl2↑+Mn2++2H2O,故答案为:MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Cl2↑+Mn2++2H2O;
③为了防止Ti被空气中的氧气氧化,故要利用生成的氯气除空气,则先加热制氯气的装置,故答案为:甲;
④C装置中盛装浓硫酸干燥氯气,利用E中盛装的氢氧化钠溶液吸收尾气中的氯气,防污染空气,故答案为:c;d;
⑤因TiCl4易水解,为防止外界水汽进入收集TiCl4装置,利用D装置中的氯化钙吸水,故答案为:防止水蒸汽进入造成产品水解.
点评 本题考查氯气的化学性质、金属冶炼及其性质,涉及实验的基本操作和反应原理,属基础性考查,难度不大,建议学生要重视双基的复习,提高分析问题解决问题的能力.

| A. | c2=2c1 | B. | c2<2c1 | C. | c2>2c1 | D. | c1=2c2 |
| A. | 向AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| B. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑ | |
| C. | 向Ca(ClO)2溶液中通入过量二氧化碳气体:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | |
| D. | 用HF刻蚀玻璃:SiO2+4H++4F-=SiF4↑+2H2O |