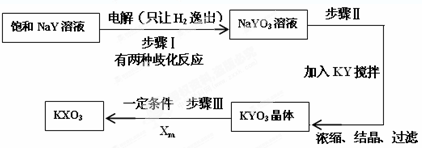
题目内容
20.某化肥厂用H2O、CO2、NH3、CaSO4、制备(NH4)2SO4,工艺流程如下: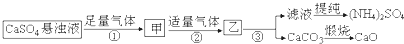
下列推断中正确的是( )
| A. | 步骤①和②中的气体属于可循环使用的气体 | |
| B. | 步骤②中发生的反应为:Ca2++CO2+2NH3•H2O═CaCO3↓+2NH4++H2O | |
| C. | 往甲中通CO2有利于(NH4)2SO4生成 | |
| D. | 以上涉及的化学反应中有氧化还原反应 |
分析 某化肥厂用H2O、CO2、NH3、CaSO4、制备(NH4)2SO4,由于氨气的溶解 度远远大于二氧化碳,所以根据题中工艺流程可知,硫酸钙悬浊液中先通入氨气得甲混合液,再通入二氧化碳得硫酸铵和碳酸钙的混合物质C,过滤得硫酸铵溶液和碳酸钙固体,碳酸钙在高温下分解生成二氧化碳和氧化钙,二氧化碳可以循环利用,硫酸铵溶液经过提纯可得硫酸铵固体,据此答题.
解答 解:某化肥厂用H2O、CO2、NH3、CaSO4、制备(NH4)2SO4,由于氨气的溶解 度远远大于二氧化碳,所以根据题中工艺流程可知,硫酸钙悬浊液中先通入氨气得甲混合液,再通入二氧化碳得硫酸铵和碳酸钙的混合物质C,过滤得硫酸铵溶液和碳酸钙固体,碳酸钙在高温下分解生成二氧化碳和氧化钙,二氧化碳可以循环利用,硫酸铵溶液经过提纯可得硫酸铵固体,
A、根据上面的分析可知,氨气不可以循环使用,二氧化碳可以循环使用,故A错误;
B、实验中用的是硫酸钙悬浊液,在离子方程式中应用化学式表示,所以步骤②中发生的反应为:CaSO4+CO2+2NH3•H2O═CaCO3↓+2NH4++H2O+SO42-,故B错误;
C、往甲中通CO2会生成碳酸钙沉淀,所以利于(NH4)2SO4生成,故C正确;
D、根据上面的分析可知,整个流程中不涉及氧化还原反应,故D错误,
故选C.
点评 本题考查了流程分析判断,物质性质的分析应用,熟记常用的化学方程式,掌握了解物质的相互转化和制备的方法及注意事项,题目难度中等.

练习册系列答案
相关题目
2.用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行中和反应,通过测定反应过程中所放出的热量(盐酸和氢氧化钠溶液的密度为1g/cm3,反应前后温度差为3.4℃,反应前后的比热容按4.18J•g-1•℃-1),则中和热为( )
| A. | -14.2 KJ/mol | B. | -28.4 KJ/mol | C. | -42.6 KJ/mol | D. | -56.8 KJ/mol |
3.铝和氢氧化钠溶液反应
化学方程式:①2Al+6HCl=2AlCl3+3H2↑,②2Al+2H2O+2NaOH=2NaAlO2+3H2↑;
离子方程式:①2Al+6H+=2Al3++3H2↑,②2Al+2OH-+2H2O=2AlO2-+3H2↑.
| 实验现象 | |
| 1.向打磨过的铝片中加入稀盐酸 | |
| 2.向打磨过的铝片中加入Na0H溶液 |
离子方程式:①2Al+6H+=2Al3++3H2↑,②2Al+2OH-+2H2O=2AlO2-+3H2↑.
9.CO2可转化成有机物实现碳循环.
(1)在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0mol•L-1,测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
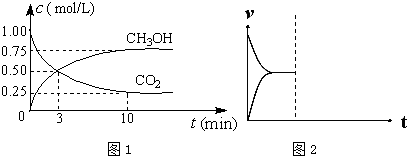
①从0min到10min,v(H2)=0.225mol•(L•min)-1.
②能说明上述反应达到平衡状态的是BD(选填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.容器内气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是AD(选填编号).
A.将H2O(g)从体系中分离B.恒温恒容充入He
C.恒温恒压充入HeD.恒温恒容再充入1mol CO2和3mol H2
(2)据报道,一定条件下由二氧化碳和氢气合成二甲醚已成为现实.
2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)在一定压强下,测得反应的实验数据如表.
分析表中数据回答下列问题:
①反应的温度升高,K值减小(填“增大”、“减小”或“不变”).
②提高氢碳比[n(H2)/n(CO2)],K值不变(填“增大”、“减小”或“不变”).
(3)800℃时,C(s)+CO2(g)?2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20mol•L-1、c(CO2)=0.05mol•L-1,此时反应向正(填“正”或“逆”)方向进行.
(4)在密闭容器中通入1mol H2和1mol CO2发生H2(g)+CO2(g)?CO(g)+H2O(g)△H>0反应,当反应达到平衡后,在其他条件不变时,若升高温度,请在图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图2.
(1)在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0mol•L-1,测得CO2和CH3OH(g)的浓度随时间变化如图1所示.

①从0min到10min,v(H2)=0.225mol•(L•min)-1.
②能说明上述反应达到平衡状态的是BD(选填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.容器内气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是AD(选填编号).
A.将H2O(g)从体系中分离B.恒温恒容充入He
C.恒温恒压充入HeD.恒温恒容再充入1mol CO2和3mol H2
(2)据报道,一定条件下由二氧化碳和氢气合成二甲醚已成为现实.
2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)在一定压强下,测得反应的实验数据如表.
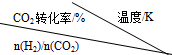 | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
①反应的温度升高,K值减小(填“增大”、“减小”或“不变”).
②提高氢碳比[n(H2)/n(CO2)],K值不变(填“增大”、“减小”或“不变”).
(3)800℃时,C(s)+CO2(g)?2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20mol•L-1、c(CO2)=0.05mol•L-1,此时反应向正(填“正”或“逆”)方向进行.
(4)在密闭容器中通入1mol H2和1mol CO2发生H2(g)+CO2(g)?CO(g)+H2O(g)△H>0反应,当反应达到平衡后,在其他条件不变时,若升高温度,请在图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图2.
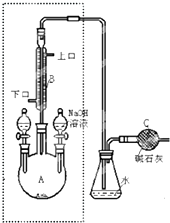 制备溴苯的实验装置如图所示,回答下列问题:
制备溴苯的实验装置如图所示,回答下列问题: )你认为该装置中可以加入苯或CCl4液体.
)你认为该装置中可以加入苯或CCl4液体.
 .
.