题目内容
【题目】为除去括号内的杂质,所选用的试剂或方法不正确的是
A. Na2CO3溶液(NaHCO3),选用适量的NaOH溶液
B. NaHCO3溶液(Na2CO3),应通入过量的CO2气体
C. Na2O2粉末(Na2O),将混合物在氧气中加热
D. Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤
【答案】D
【解析】
NaHCO3+NaOH===Na2CO3+H2O,由于NaOH适量,A项正确;Na2CO3+CO2+H2O===2NaHCO3,通入CO2可以将少量的Na2CO3转化为NaHCO3而除去,B项正确;2Na2O+O2![]() 2Na2O2,在空气中可以将少量的Na2O转化为Na2O2而除去,C项正确;Na2CO3+Ba(OH)2===BaCO3↓+2NaOH,Na2SO4+Ba(OH)2===BaSO4↓+2NaOH,D项错误。
2Na2O2,在空气中可以将少量的Na2O转化为Na2O2而除去,C项正确;Na2CO3+Ba(OH)2===BaCO3↓+2NaOH,Na2SO4+Ba(OH)2===BaSO4↓+2NaOH,D项错误。

【题目】铬是重要的战略物质之一,由于具有质硬,耐磨,耐高温,抗腐蚀性等特性,所以在工业上应用比较广泛,在冶金工业上主要用铬铁矿(Cr2O3 、FeO、SiO2 、Al2O3 等,其它杂质不参加反应)生产铬和铁等金属。流程如下:
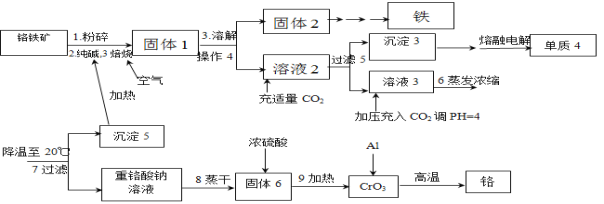
已知:2Cr2O3+3O2+4Na2CO3![]() 4Na2CrO4+4CO2;部分物质的溶解度(单位g)
4Na2CrO4+4CO2;部分物质的溶解度(单位g)
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | |
Na2CO3 | 7.0 | 13 | 29 | 40 | 49 | 46 | 44 |
NaHCO3 | 6.9 | 8.5 | 9.6 | 11.1 | 12.7 | 14.4 | 16.9 |
Na2Cr2O7 | 161 | 170 | 183 | 198 | 218 | 240 | 265 |
(1)粉碎的目的
(2)写出焙烧时含铝物质发生的化学反应方程式_______________________________;
(3)操作4是_______________________,沉淀3含有的物质有_____________________;
(4)写出生成沉淀5的离子方程式_____________________________________________;
(5)整个流程可以循环使用的物质有___________________________;
(6)最后一步制备金属铬的化学方程式______________________________。