题目内容
【题目】(1)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。
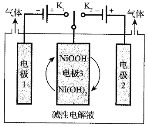
(2)氢能源是最具应用前景的能源之一,高纯氢制备是目前的研究热点。可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。
①制H2时,连接_______________(填K1或者K2)。产生H2的电极反应式是_____________。
②改变开关连接方式,可得O2,写出制备氧气时电极3对应的电极反应式是_______________。
【答案】NaOH溶液 Na2CO3溶液 K1 2H2O+2e=H2↑+2OH NiOOH+H2O+ e=Ni(OH)2 + OH
【解析】
选择NaOH除去食盐水中的Mg2+,选择碳酸钠除去食盐水中的Ca2+,
(1)食盐溶液中混有Mg2+和Ca2+,可以利用过量NaOH溶液除去Mg2+,利用过量Na2CO3溶液除去Ca2+,
(2)①电解水生成氢气和氧气,氧气在阳极生成,氢气在阴极生成,则应连接K1,电极方程式为2H2O+2e-=H2↑+2OH-,
故答案为:K1;2H2O+2e-=H2↑+2OH-;
②电极3可分别连接K1或K2,①中电极3发生Ni(OH)2-e-+OH-=NiOOH+H2O,制氢气时消耗电极1产生的OH-,②中电极3发生NiOOH+H2O+e-=Ni(OH)2+OH-,制氧气时补充电极2消耗的OH-,实现NiOOHNi(OH)2的转化,且可循环使用,
故答案为:①中电极3发生Ni(OH)2-e-+OH-=NiOOH+H2O,制氢气时消耗电极1产生的OH-,②中电极3发生NiOOH+H2O+e-=Ni(OH)2+OH-。

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目