题目内容
【题目】(1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察图示,然后回答问题:
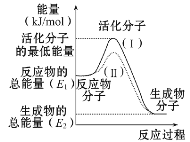
①图中所示反应是________(填“吸热”或“放热”)反应,,该反应的ΔH=________ (用含E1、E2的代数式表示)。
②已知热化学方程式:H2(g)+ ![]() O2(g)=H2O(g) ΔH=-241.8 kJ/mol。该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为_____________。
O2(g)=H2O(g) ΔH=-241.8 kJ/mol。该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为_____________。
(2)已知反应2HI(g)![]() H2(g)+I2(g)的ΔH=+11 kJ·mol-1,1 mol H2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为________kJ。
H2(g)+I2(g)的ΔH=+11 kJ·mol-1,1 mol H2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为________kJ。
【答案】放热 -(E1-E2) 409kJ/mol 299
【解析】
(1)依据图象分析反应物的能量大于生成物的能量,反应放热;在化学反应中,只有能量比平均能量高得多的反应物的活化分子发生碰撞时才能发生化学反应,反应需要能量;反应的焓变=生成物的能量-反应物的能量;
(3)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,逆反应的活化能=正反应的活化能+反应的焓变;
正反应为吸热反应,化学键断裂时需吸收的能量-化学键生成时需放出的能量=反应吸收的热量,以此解答该题.
(1) ①依据图象分析反应物的能量大于生成物的能量,反应放热;在化学反应中,只有能量比平均能量高得多的反应物的活化分子发生碰撞时才能发生化学反应,反应需要能量;反应的焓变=生成物的能量反应物的能量;△H=(E2E1)KJ/mol;
故答案为:放热;(E2E1)KJ/mol;
②反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,逆反应的活化能=正反应的活化能-反应的焓变; H2(g)+ 1/2O2(g)=H2O(g) ΔH=-241.8 kJ/mol,该反应的活化能为167.2kJmol1,则其逆反应的活化能=167.2KJ/mol+241.8KJ/mol=409.0KJ/mol;
故答案为:409.0KJ/mol;
(2)设1molHI(g)分子中化学键断裂时需吸收的能量为xkJ,则:2xkJ436kJ151kJ=11kJ,解得x=299,
故答案为:299.

 阅读快车系列答案
阅读快车系列答案【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次从左至右发生的反应类型和反应条件都正确的是 ( )
选项 | 反应类型 | 反应条件 |
A | 加成反应;取代反应;消去反应 | KOH醇溶液 |
B | 消去反应;加成反应;取代反应 | NaOH水溶液 |
C | 氧化反应;取代反应;消去反应 | 加热;KOH醇溶液 |
D | 消去反应;加成反应;水解反应 | NaOH醇溶液 |
A.AB.BC.CD.D