题目内容
12.(1)分析下列物质的物理性质,判断其晶体类型.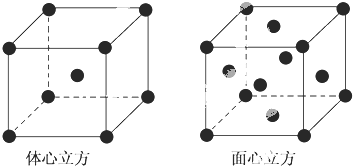
A.碳化铝,黄色晶体,熔点2200℃,熔融态不导电原子晶体;
B.溴化铝,无色晶体,熔点98℃,熔融态不导电分子晶体;
C.五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中分子晶体;
D.溴化钾,无色晶体,熔融时或溶于水中都能导电离子晶体.
(2)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体为分子晶体.
(3)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为1:2.
分析 (1)A.原子晶体熔沸点较高且熔融态不导电;
B.分子晶体熔沸点较低,熔融态不导电;
C.分子晶体熔沸点较高,熔融态不导电;
D.可溶性离子晶体熔融态和溶于水都导电;
(2)分子晶体熔沸点较低;
(3)利用均摊法确定晶胞中铁原子个数,从而确定其原子个数之比.
解答 解:(1)A.碳化铝熔沸点较高且熔融态不导电,说明熔融态该物质不发生电离,只发生化学键的断裂,为原子晶体;
B.溴化铝熔沸点较低且熔融态不导电,说明熔融态该物质不发生电离,只发生化学键的断裂,为分子晶体;
C.五氟化钒熔沸点较低且易溶于乙醇、氯仿、丙酮中,说明为分子晶体;
D.溴化钾在熔融状态或水溶液中都导电,说明该物质能电离出自由移动的阴阳离子,为离子晶体;
故答案为:原子晶体;分子晶体;分子晶体;离子晶体;
(2)氯化铁熔沸点较低且易溶于水,也易溶于乙醚、丙酮等有机溶剂,则氯化铁属于分子晶体,故答案为:分子晶体;
(3)体心立方中Fe原子个数=1+8×1818=2、面心立方中Fe原子个数=8×1818+6×1212=4,所以面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比=2:4=1:2,
故答案为:1:2.
点评 本题考查晶体类型判断、晶胞计算等知识点,侧重考查学生比较分析、空间想象、计算能力,熟悉常见晶体类型及构成微粒、熔沸点大小,会利用均摊法计算晶胞中原子个数,题目难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
2.铝和铁是重要的金属元素,请回答下列问题:
Ⅰ、(1)铁与水反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)△H
已知:①3Fe(s)+2O2(g)?Fe3O4(s)△H1=-1118.4kJ/mol
②2H2(g)+O2(g)?2H2O(g)△H2=-483.8kJ/mol
③2H2(g)+O2(g)?2H2O(l)△H3=-571.8kJ/mol
则△H=-150.8KJ/mol(计算结果保留一位小数).
(2)①在t℃时,该反应达到平衡状态测得混合气体平均相对分子质量为223223,则反应的平衡常数K=16.
②下列说法正确的是B(填字母序号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内密度恒定,则反应达到平衡状态
C.恒温恒容平衡后,加入少量H2,再次平衡后,H2O(g)的体积分数减少
D.增加Fe3O4就能提高H2O的转化率
(3)若反就发生在恒容绝热的装置中,按下表充入起始物质,起始时与平衡后的各物质的量见下表:
若在达平衡后的装置中继续加入A,B,C三种状况下的各物质,见上表:
当上述可逆反应再一次达到平衡状态后,将上述各装置中H2的体积分数由大到小的顺序排列:B>C>A(用A,B,C表示)
Ⅱ.离子液体是一室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.
(1)钢制品应接电源的负极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为4Al2Cl7-+3e-=Al+7AlCl4-.
(2)若改用AlCl3水溶液作电解液,则一段时间后不能生成AlO2-离子.(填能或不能)
Ⅰ、(1)铁与水反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)△H
已知:①3Fe(s)+2O2(g)?Fe3O4(s)△H1=-1118.4kJ/mol
②2H2(g)+O2(g)?2H2O(g)△H2=-483.8kJ/mol
③2H2(g)+O2(g)?2H2O(l)△H3=-571.8kJ/mol
则△H=-150.8KJ/mol(计算结果保留一位小数).
(2)①在t℃时,该反应达到平衡状态测得混合气体平均相对分子质量为223223,则反应的平衡常数K=16.
②下列说法正确的是B(填字母序号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内密度恒定,则反应达到平衡状态
C.恒温恒容平衡后,加入少量H2,再次平衡后,H2O(g)的体积分数减少
D.增加Fe3O4就能提高H2O的转化率
(3)若反就发生在恒容绝热的装置中,按下表充入起始物质,起始时与平衡后的各物质的量见下表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | Q |
| Fe | H2O(g) | F3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | Q |
当上述可逆反应再一次达到平衡状态后,将上述各装置中H2的体积分数由大到小的顺序排列:B>C>A(用A,B,C表示)
Ⅱ.离子液体是一室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.
(1)钢制品应接电源的负极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为4Al2Cl7-+3e-=Al+7AlCl4-.
(2)若改用AlCl3水溶液作电解液,则一段时间后不能生成AlO2-离子.(填能或不能)
3.已知在苯分子中,不存在单、双键交替的结构.下列可以作为证据的实验事实是:
①苯不能使酸性KMnO4溶液褪色 ②苯中6个碳碳键完全相同
③苯能在一定条件下与氢气加成生成环己烷 ④实验室测得邻二甲苯只有一种结构
⑤苯不能使溴水因反应而褪色( )
①苯不能使酸性KMnO4溶液褪色 ②苯中6个碳碳键完全相同
③苯能在一定条件下与氢气加成生成环己烷 ④实验室测得邻二甲苯只有一种结构
⑤苯不能使溴水因反应而褪色( )
| A. | ②③④⑤ | B. | ①③④⑤ | C. | ①②③④ | D. | ①②④⑤ |
20.取pH均等于2的盐酸和醋酸溶液各100mL.分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是( )
| A. | 醋酸与锌反应放出的氢气多 | |
| B. | 盐酸和醋酸分别与锌反应放出的氢气一样多 | |
| C. | 醋酸与锌反应所需时间长 | |
| D. | 盐酸和醋酸分别与锌反应所需时间一样长 |
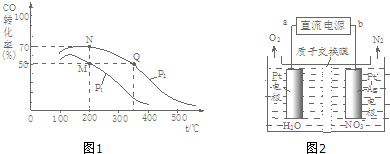
7. 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸气和水蒸气.如图表示恒压容器中0.5molCO2和1.5molH2转化率达80%时的能量变化示意图.能判断该反应达到化学平衡状态的依据是bd.(填字母)
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂.
(2)将不同量的CO(g)和H2O分别通入到体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①实验2条件下平衡常数K=1616.
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b的值0<abab<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1 mol时,则此时v(正)<v(逆)(填“<”“>”或“=”).
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
(4)已知草酸是一种二元弱酸,草酸氢钠溶液显酸性.常温下,向10mL 0.01mol/L H2C2O4溶液中滴加10mL0.01mol/L NaOH溶液,比较溶液中各种离子浓度的大小关系c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
(5)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,该电池的负极反应式为CH3OCH3-12e-+16OH-=2CO32-+11H2O.
 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸气和水蒸气.如图表示恒压容器中0.5molCO2和1.5molH2转化率达80%时的能量变化示意图.能判断该反应达到化学平衡状态的依据是bd.(填字母)
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂.
(2)将不同量的CO(g)和H2O分别通入到体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度 ℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min[ | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b的值0<abab<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1 mol时,则此时v(正)<v(逆)(填“<”“>”或“=”).
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
(4)已知草酸是一种二元弱酸,草酸氢钠溶液显酸性.常温下,向10mL 0.01mol/L H2C2O4溶液中滴加10mL0.01mol/L NaOH溶液,比较溶液中各种离子浓度的大小关系c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
(5)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,该电池的负极反应式为CH3OCH3-12e-+16OH-=2CO32-+11H2O.