题目内容
8.利用太阳光能分解水制氢气是未来解决能源危机的理想方法之一.某研究小组设计了如图所示的循环系统实现光能分解水制氢气.反应过程中所需的电能由太阳光能电池提供,反应体系中I2和Fe3+等可循环使用.则下列有关结论中不正确的是( )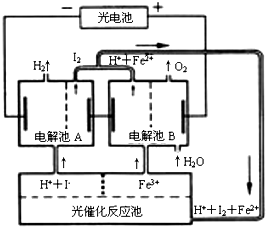
| A. | 外电路中每通过0.2 mol电子,电解池B中就会生成1.12L氧气 | |
| B. | 光催化反应池中离子反应式是:2Fe2++I2$\frac{\underline{\;光照\;}}{\;}$Fe3++2I- | |
| C. | 电解池B中阴极反应式是:Fe3++e-═Fe2+ | |
| D. | 电解池A的阳极反应式是:2I--2e-═I2 |
分析 A.温度和压强未知导致气体摩尔体积未知,所以无法计算气体体积;
B.根据图片知,光电池中亚铁离子、碘反应生成铁离子、碘离子;
C.电解池B中阴极上铁离子得电子发生还原反应;
D.电解池A中阴极上碘离子失电子发生氧化反应.
解答 解:A.温度和压强未知导致气体摩尔体积未知,能根据氧气和电子之间的关系式计算氧气物质的量,但无法计算气体体积,故A错误;
B.根据图片知,光电池中亚铁离子、碘反应生成铁离子、碘离子,离子反应方程式为2Fe2++I2$\frac{\underline{\;光照\;}}{\;}$Fe3++2I-,故B正确;
C.电解池B中阴极上铁离子得电子发生还原反应,电极反应式为Fe3++e-═Fe2+,故C正确;
D.电解池A中阴极上碘离子失电子发生氧化反应,电极反应式为2I--2e-═I2,故D正确;
故选A.
点评 本题考查化学电源新型电池,正确书写各个电极反应式是解本题关键,为高考高频点,熟悉图片中各个电极发生的反应,易错选项A,注意气体摩尔体积适用范围及适用条件.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
19.右图表示容积固定的密闭容器中进行的某一可逆反应,A(g)+2B(g)?2C(g),以B的浓度变化表示的反应速率与时间的关系,已知速率的单位为mol/(L•s)图中阴影部分的数值相当于( )
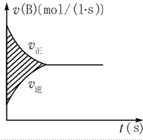

| A. | A浓度的减小量 | B. | B浓度的减小量 | ||
| C. | C物质的量的增加量 | D. | B物质的量的减少量 |
2.铝和铁是重要的金属元素,请回答下列问题:
Ⅰ、(1)铁与水反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)△H
已知:①3Fe(s)+2O2(g)?Fe3O4(s)△H1=-1118.4kJ/mol
②2H2(g)+O2(g)?2H2O(g)△H2=-483.8kJ/mol
③2H2(g)+O2(g)?2H2O(l)△H3=-571.8kJ/mol
则△H=-150.8KJ/mol(计算结果保留一位小数).
(2)①在t℃时,该反应达到平衡状态测得混合气体平均相对分子质量为$\frac{22}{3}$,则反应的平衡常数K=16.
②下列说法正确的是B(填字母序号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内密度恒定,则反应达到平衡状态
C.恒温恒容平衡后,加入少量H2,再次平衡后,H2O(g)的体积分数减少
D.增加Fe3O4就能提高H2O的转化率
(3)若反就发生在恒容绝热的装置中,按下表充入起始物质,起始时与平衡后的各物质的量见下表:
若在达平衡后的装置中继续加入A,B,C三种状况下的各物质,见上表:
当上述可逆反应再一次达到平衡状态后,将上述各装置中H2的体积分数由大到小的顺序排列:B>C>A(用A,B,C表示)
Ⅱ.离子液体是一室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.
(1)钢制品应接电源的负极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为4Al2Cl7-+3e-=Al+7AlCl4-.
(2)若改用AlCl3水溶液作电解液,则一段时间后不能生成AlO2-离子.(填能或不能)
Ⅰ、(1)铁与水反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)△H
已知:①3Fe(s)+2O2(g)?Fe3O4(s)△H1=-1118.4kJ/mol
②2H2(g)+O2(g)?2H2O(g)△H2=-483.8kJ/mol
③2H2(g)+O2(g)?2H2O(l)△H3=-571.8kJ/mol
则△H=-150.8KJ/mol(计算结果保留一位小数).
(2)①在t℃时,该反应达到平衡状态测得混合气体平均相对分子质量为$\frac{22}{3}$,则反应的平衡常数K=16.
②下列说法正确的是B(填字母序号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内密度恒定,则反应达到平衡状态
C.恒温恒容平衡后,加入少量H2,再次平衡后,H2O(g)的体积分数减少
D.增加Fe3O4就能提高H2O的转化率
(3)若反就发生在恒容绝热的装置中,按下表充入起始物质,起始时与平衡后的各物质的量见下表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | Q |
| Fe | H2O(g) | F3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | Q |
当上述可逆反应再一次达到平衡状态后,将上述各装置中H2的体积分数由大到小的顺序排列:B>C>A(用A,B,C表示)
Ⅱ.离子液体是一室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.
(1)钢制品应接电源的负极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为4Al2Cl7-+3e-=Al+7AlCl4-.
(2)若改用AlCl3水溶液作电解液,则一段时间后不能生成AlO2-离子.(填能或不能)
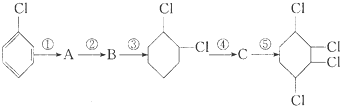
 ,B:
,B: ,C:
,C: .
. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$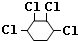 .
.