题目内容
11.某温度和压强下,将4g由3种炔烃(分子中只含有一个 )组成的混合气体与足量的H2反应,充分加成后,生成4.4g3种对应的烷径中一定有( )
)组成的混合气体与足量的H2反应,充分加成后,生成4.4g3种对应的烷径中一定有( )| A. | 乙炔 | B. | 乙烷 | C. | 丙炔 | D. | 丙烷 |
分析 一定条件下三种炔烃组成的混合气体4.0g,与足量的氢气充分加成后可生成4.4g烷烃,则需氢气的质量为4.4g-4.0g=0.4g,n(H2)=$\frac{0.4g}{2g/mol}$=0.2mol,结合n(炔烃)~2n(H2)计算.
解答 解:一定条件下三种炔烃组成的混合气体4g,与足量的氢气充分加成后可生成4.4g烷烃,
则需氢气的质量为:4.4g-4g=0.4g,
0.4g氢气的物质的量为:n(H2)=$\frac{0.4g}{2g/mol}$=0.2mol,
炔烃与氢气加成的关系式为:n(炔烃)~2n(H2),
则炔烃的物质的量为:0.2mol×$\frac{1}{2}$=0.1mol,
所以该混合炔烃的平均摩尔质量为:M(炔烃)=$\frac{4.0g}{0.1mol}$=40g/mol,
则混合物中一定含有相对分子质量小于40的炔烃,
所以一定含有乙炔,乙炔加成后生成乙烷,
即:生成的3种烷烃中一定含有乙烷,
故选B.
点评 本题考查混合物的计算,题目难度中等,试题侧重考查有机物分子式的确定,注意根据有机物质量关系确定参加反应的氢气的质量,结合反应的关系式计算.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案
相关题目
2.铝和铁是重要的金属元素,请回答下列问题:
Ⅰ、(1)铁与水反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)△H
已知:①3Fe(s)+2O2(g)?Fe3O4(s)△H1=-1118.4kJ/mol
②2H2(g)+O2(g)?2H2O(g)△H2=-483.8kJ/mol
③2H2(g)+O2(g)?2H2O(l)△H3=-571.8kJ/mol
则△H=-150.8KJ/mol(计算结果保留一位小数).
(2)①在t℃时,该反应达到平衡状态测得混合气体平均相对分子质量为$\frac{22}{3}$,则反应的平衡常数K=16.
②下列说法正确的是B(填字母序号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内密度恒定,则反应达到平衡状态
C.恒温恒容平衡后,加入少量H2,再次平衡后,H2O(g)的体积分数减少
D.增加Fe3O4就能提高H2O的转化率
(3)若反就发生在恒容绝热的装置中,按下表充入起始物质,起始时与平衡后的各物质的量见下表:
若在达平衡后的装置中继续加入A,B,C三种状况下的各物质,见上表:
当上述可逆反应再一次达到平衡状态后,将上述各装置中H2的体积分数由大到小的顺序排列:B>C>A(用A,B,C表示)
Ⅱ.离子液体是一室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.
(1)钢制品应接电源的负极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为4Al2Cl7-+3e-=Al+7AlCl4-.
(2)若改用AlCl3水溶液作电解液,则一段时间后不能生成AlO2-离子.(填能或不能)
Ⅰ、(1)铁与水反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)△H
已知:①3Fe(s)+2O2(g)?Fe3O4(s)△H1=-1118.4kJ/mol
②2H2(g)+O2(g)?2H2O(g)△H2=-483.8kJ/mol
③2H2(g)+O2(g)?2H2O(l)△H3=-571.8kJ/mol
则△H=-150.8KJ/mol(计算结果保留一位小数).
(2)①在t℃时,该反应达到平衡状态测得混合气体平均相对分子质量为$\frac{22}{3}$,则反应的平衡常数K=16.
②下列说法正确的是B(填字母序号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内密度恒定,则反应达到平衡状态
C.恒温恒容平衡后,加入少量H2,再次平衡后,H2O(g)的体积分数减少
D.增加Fe3O4就能提高H2O的转化率
(3)若反就发生在恒容绝热的装置中,按下表充入起始物质,起始时与平衡后的各物质的量见下表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | Q |
| Fe | H2O(g) | F3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | Q |
当上述可逆反应再一次达到平衡状态后,将上述各装置中H2的体积分数由大到小的顺序排列:B>C>A(用A,B,C表示)
Ⅱ.离子液体是一室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.
(1)钢制品应接电源的负极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为4Al2Cl7-+3e-=Al+7AlCl4-.
(2)若改用AlCl3水溶液作电解液,则一段时间后不能生成AlO2-离子.(填能或不能)
19.将3.84g铜粉与一定质量浓硝酸反应,当铜完全作用时,收集到气体2.24L(标准状况下),则所消耗酸的物质的量是( )
| A. | 0.11mol | B. | 0.22mol | C. | 0.16mol | D. | 0.1mol |
6.下列物质中,不属于有机物的是( )
| A. | CCl4 | B. | CH3COOH | C. | CH3CH2OH | D. | CaCO3 |
3.已知在苯分子中,不存在单、双键交替的结构.下列可以作为证据的实验事实是:
①苯不能使酸性KMnO4溶液褪色 ②苯中6个碳碳键完全相同
③苯能在一定条件下与氢气加成生成环己烷 ④实验室测得邻二甲苯只有一种结构
⑤苯不能使溴水因反应而褪色( )
①苯不能使酸性KMnO4溶液褪色 ②苯中6个碳碳键完全相同
③苯能在一定条件下与氢气加成生成环己烷 ④实验室测得邻二甲苯只有一种结构
⑤苯不能使溴水因反应而褪色( )
| A. | ②③④⑤ | B. | ①③④⑤ | C. | ①②③④ | D. | ①②④⑤ |
20.取pH均等于2的盐酸和醋酸溶液各100mL.分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是( )
| A. | 醋酸与锌反应放出的氢气多 | |
| B. | 盐酸和醋酸分别与锌反应放出的氢气一样多 | |
| C. | 醋酸与锌反应所需时间长 | |
| D. | 盐酸和醋酸分别与锌反应所需时间一样长 |
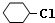 ,B:
,B: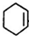 ,C:
,C: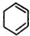 .
.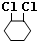 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$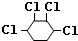 .
.