题目内容
13.碳和碳的化合物在生产、生活中的应用非常广泛,“低碳生活”已成潮流,清洁能源的开发、煤的综合利用等是实现“低碳生活”的重要途径.试运用所学知识,回答下列问题:(1)甲烷是一种重要的清洁燃料
①甲烷燃烧放出大量的热,可直接作为能源用于人类的生产和生活.
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H1=-1214kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ/mol
则表示甲烷燃烧热的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890KJ.mol-1;请从化学反应的本质解释甲烷燃烧放出热量的原因:化学反应过程中,反应物化学键的破坏需要吸收能量,而生产物化学键的形成要放出能量,当化学键的破坏需要吸收能量小于化学键的形成要放出能量.
②在甲烷燃料电池中,甲烷的化学能利用率大大提高.将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,其负极电极反应式是:CH4-8e-+10 OH-=CO32-+7H2O.
(2)二甲醚也是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.
①利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ/mol
该反应在一定条件下的密闭容器中达到平衡后,为同时提高反应速率和二甲醚的产率,可以采取的措施是bd (填字母代号).
a.降低温度 b.缩小容器体积 c.加入催化剂
d.增加H2的浓度 e.分离出二甲醚
②二甲醚也可以通过CH3OH分子间脱水制得
2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
已知在280℃,体积不变的密闭容器中进行上述反应,t2时达到平衡,各组分起始和平衡浓度见下表.
| CH3OH(g) | CH3OCH3(g) | H2O(g) | |
| 起始浓度 mol/L | 2.00 | 0.50 | 0 |
| 平衡浓度 mol/L | c1 | 1.00 | c2 |
在t2min内平均反应速率v(H2O)=$\frac{1}{2{t}_{2}}$mol/(L.min).
②若在400℃,相同的密闭容器中进行上述反应,请在下图中画出CH3OCH3浓度随时间变化的关系图(要求同时画出280℃的,并做好标注).
分析 (1)①已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H1=-1214kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ/mol
根据盖斯定律,(①+②)×$\frac{1}{2}$可得:CH4(g)+2O2(g)=CO2(g)+2H2O(l),反应热也进行相应计算;
化学反应过程中,反应物化学键的破坏需要吸收能量,而生产物化学键的形成要放出能量,当化学键的破坏需要吸收能量小于化学键的形成要放出能量;
②负极发生氧化反应,甲烷在负极上失去电子,碱性条件下生成碳酸根离子与水;
(2)①a.降低温度反应速率减慢;
b.缩小容器体积,压强增大,反应速率加快,平衡向气体体积减小的方向移动;
c.加入催化剂不影响平衡移动;
d.增加H2的浓度,反应速率加快,平衡正向移动;
e.分离出二甲醚,反应速率减慢;
②.①平衡时甲醚浓度变化量为1mol/L-0.5mol/L=0.5mol/L,由方程式可知甲醇的浓度变化量为1mol/L,水的浓度变化量为0.5mol/L,甲醇的平衡浓度=甲醇起始浓度-浓度变化量,根据v=$\frac{△c}{△t}$计算v(H2O);
②升高温度反应速率加快,到达平衡的水解缩短,开始阶段反应速率高于280℃,正反应为放热反应,升高温度平衡逆向移动,平衡时甲醚的浓度小于1mol/L,
解答 解:(1)①已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H1=-1214kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ/mol
根据盖斯定律,(①+②)×$\frac{1}{2}$可得:CH4(g)+2O2(g)=CO2(g)+2H2O(l),故热化学方程式为:
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890KJ.mol-1,
化学反应过程中,反应物化学键的破坏需要吸收能量,而生产物化学键的形成要放出能量,当化学键的破坏需要吸收能量小于化学键的形成要放出能量,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890KJ.mol-1;化学反应过程中,反应物化学键的破坏需要吸收能量,而生产物化学键的形成要放出能量,当化学键的破坏需要吸收能量小于化学键的形成要放出能量;
②负极发生氧化反应,甲烷在负极上失去电子,碱性条件下生成碳酸根离子与水,负极电极反应式为:CH4-8e-+10 OH-=CO32-+7H2O,
故答案为:CH4-8e-+10 OH-=CO32-+7H2O;
(2)①a.正反应为放热反应,降低温度平衡逆向移动,二甲醚的产率降低,降低温度反应速率减慢,故a错误;
b.缩小容器体积,压强增大,反应速率加快,平衡向正向移动,二甲醚的产率增大,故b正确;
c.加入催化剂加快反应速率,但不影响平衡移动,二甲醚的产率不变,故c错误;
d.增加H2的浓度,反应速率加快,平衡正向移动,二甲醚的产率增大,故d正确;
e.分离出二甲醚,平衡正向移动,二甲醚的产率增大,但反应速率减慢,故e错误,
故选:bd;
②.①平衡时甲醚浓度变化量为1mol/L-0.5mol/L=0.5mol/L,
2CH3OH(g)?CH3OCH3(g)+H2O(g)
起始量(mol/L):2 0.5 0
变化量(mol/L):1 0.5 0.5
平衡量(mol/L):1 1 0.5
则表中c1=1mol/L,在t2min内平均反应速率v(H2O)=$\frac{0.5mol/L}{{t}_{2}min}$=$\frac{1}{2{t}_{2}}$mol/(L.min),
故答案为:1;$\frac{1}{2{t}_{2}}$mol/(L.min);
②升高温度反应速率加快,到达平衡的水解缩短,开始阶段反应速率高于280℃,正反应为放热反应,升高温度平衡逆向移动,平衡时甲醚的浓度小于1mol/L,
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1,温度升高,化学反应速率加快,达到平衡的时间小于t2,平衡逆向移动,达到平衡时,CH3OCH3浓度小于1.00mol/L,CH3OCH3浓度随时问变化的关系图为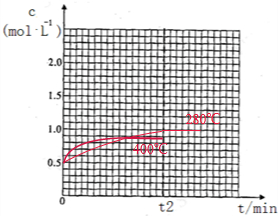 ,
,
故答案为: .
.
点评 本题考查化学平衡计算及影响因素、热化学方程式书写、原电池等,较好的考查学生分析解决问题的能力,难度中等.

| A. | 熔点:Br2>Cl2>F2 | B. | 氧化性:Cl2>Br2>I2 | ||
| C. | 酸性:HClO4>HBrO4>HIO4 | D. | 稳定性:HI>HBr>HCl>HF |
| A. | 必定是可溶性氯化物 | B. | 可能是可溶性碳酸盐 | ||
| C. | 可能含有Cl- | D. | 必定是氯水 |
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
(1)反应0~2min Z的平均速率v(Z)=0.004 mol/(L•min)
(2)能判断该反应已经达到平衡状态的是D
A.生成X的速率是生成Z的速率的2倍 B.容器内压强保持不变
C.容器内气体的密度保持不变 D.容器内各气体的浓度保持不变
(3)要提高上述反应的转化率,可采取的措施是降低温度(任写一种).
(4)温度为300℃时,该反应的化学平衡常数K=1.44
(5)若起始时向该容器中充入X、Y、Z各0.20mol,则反应将向正(填“正”或“逆”)反应方向进行,达平衡时Z的体积分数与上述平衡相比不变(填“增大”、“减小”或“不变”)

 ,固体A的化学式为Al(OH)3;
,固体A的化学式为Al(OH)3;
 .
.