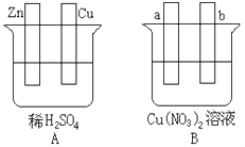
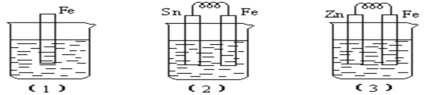
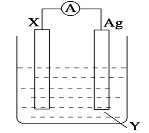
题目内容
【题目】新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高电子层符号为__________,该电子层具有的原子轨道数为______.
②LiBH4由Li+和BH![]() 构成,BH
构成,BH![]() 的立体构型是______,B原子的杂化轨道类型是_______.
的立体构型是______,B原子的杂化轨道类型是_______.
③Li、B元素的电负性由小到大的顺序为_______________________.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+________H-(填“>”“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物. M的部分电离能如下表所示:
I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
738 | 1 451 | 7 733 | 10 540 | 13 630 |
M是________族元素.
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488 pm,Na+半径为102 pm,H-的半径为142pm,NaH的理论密度是________g·cm-3.(仅写表达式,不计算)
【答案】M 9 正四面体 sp3 Li<B < ⅡA ![]() ÷(488×10-10 cm)3
÷(488×10-10 cm)3
【解析】
(1)①基态Cl原子的电子排布式为1s22s22p63s23p5,电子占据的最高电子层为第3层,符号为M,s轨道1个,p轨道3个,同时M层有3d轨道,d轨道有5个,合计9个。
②BH4-中,B的轨道杂化数目为4+(3+11×4)/2=4,B采取sp3杂化,为正四面体构型。
③一般而言,同周期越往右电负性越强,同主族越往上电负性越强,因而Li<B。
(2)①离子半径判断原则首先判断电子层数,“层多径大”,其次,当电子层数一样,原子核核电荷数越大,半径越小,因而,易知Li+和H-的电子层数一样,但H的核电荷数较小,因而Li+小于H-。
②第二电离能和第三电离能相差5倍多,说明从电离第3个电子时,其结构是稳定的,像稀有气体的外层电子结构,因而最外层为2个电子,又M是短周期元素,最外层电子数等于主族序数,说明M是ⅡA族。
(3)NaH具有NaCl型晶体结构,说明晶胞内有4个Na+和4个H-,则晶胞内原子总质量m=![]() g,V=a3=(488×10-10 cm)3,ρ=
g,V=a3=(488×10-10 cm)3,ρ=![]() g÷(488×10-10 cm)3。
g÷(488×10-10 cm)3。

【题目】“绿水青山就是金山银山”,因此研究NOx,SO2等大气污染物的妥善处理具有重要意义。
SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)=NH4HSO3(aq) △H1=akJ/mo1;
②NH3·H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) △H2=b kJ/mo1;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) △H3=c kJ/mo1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O △H
(1)△H =______kJ/mo1 (用含a、b、c的代数式表示)。
(2)对于反应:C(s)+2NO(g)![]() N2(g)+CO2(g) △H =-34.0kJ/mol,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
N2(g)+CO2(g) △H =-34.0kJ/mol,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10min内,CO2的平均反应速度v(CO2)=________。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是_______(填字母)。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
(3)用活性炭还原法处理NO,有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g) △H =-34.0kJ/mo1。已知在一体积不变的密闭容器中,加入足量的C和一定量的NO气体,测得NO的转化率随温度的变化如下图所示:
N2(g)+CO2(g) △H =-34.0kJ/mo1。已知在一体积不变的密闭容器中,加入足量的C和一定量的NO气体,测得NO的转化率随温度的变化如下图所示:

①由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为________;
②在1100K时,CO2的体积分数为________。
(4)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H =-746.8 kJ/mo1,生成无毒的N2和CO2。实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2) (k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) △H =-746.8 kJ/mo1,生成无毒的N2和CO2。实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2) (k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数____(填“>”“<”或“=”) k逆增大的倍数。
②若在2L的密闭容器中充入2molCO和2molNO,在一定温度下达到平衡时,CO的转化率为50%,则![]() _______。
_______。