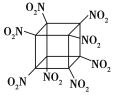
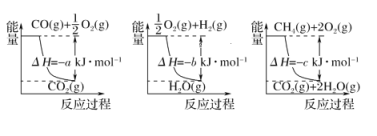
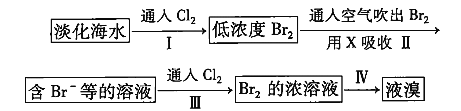
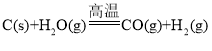题目内容
【题目】氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点-54.1℃,沸点69.1℃。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g)![]() SO2Cl2(l)△H=-97.3kJ/mol
SO2Cl2(l)△H=-97.3kJ/mol
(1)若在此条件下,将化学平衡常数K减小,化学反应速率v正增大,可采取的措施是___(选填编号)。
a.升高温度 b.移走SO2Cl2 c.增加反应物浓度 d.无法满足上述条件
(2)为了提高上述反应中Cl2的平衡转化率,下列措施合理的是___(选填编号)。
a.缩小容器体积 b.使用催化剂 c.增加SO2浓度 d.升高温度
(3)在100℃时,往上述平衡体系中加入37Cl2,一段时间后,则平衡体系中含有37Cl的物质有___(选填编号)。
a.只有37Cl2 b.只有SO237Cl2 c.37Cl2和SO237Cl2 d.无法判断
(4)下列描述中能说明上述反应已达平衡状态的是____(选填编号)。
a.υ(Cl2)= υ(SO2) b.容器中气体压强不随时间而变化
c.c(Cl2) :c(SO2)=1 :1 d.容器中气体颜色不随时间而变化
(5)300℃时,体积为1L的密闭容器中充入16g SO2Cl2,达到平衡时容器中含SO2 7g。若在上述的平衡体系中,再加入16g SO2Cl2,当再次达平衡时,容器中含SO2的质量范围是__。
【答案】a ac c bd 7g<m(SO2)<14g
【解析】
应从勒夏特列原理的规律、达到化学平衡状态、等效平衡等知识入手分析;
(1)化学平衡常数只受温度的影响,题中K值减小,因为正反应为放热反应,因此采取的措施为升高温度,升高温度,加快反应速率,故a符合题意;
(2)上述反应中提高Cl2的平衡转化率,说明平衡向正反应方向移动,a、缩小容器的体积,压强增大,根据所给反应,反应前气体分子数之和大于反应后气体分子数之和,因此增大压强,平衡向正反应方向进行,Cl2的转化率增大,故a符合题意;
b、使用催化剂,化学平衡不移动,氯气的转化率不变,故b不符合题意;
c、增加SO2浓度,增加反应物浓度,平衡向正反应方向移动,Cl2的转化率增大,故c符合题意;
d、该反应为放热反应,升高温度,平衡向逆反应方向进行,氯气的转化率降低,故d不符合题意;
(3)该反应是可逆反应,反应物和生成物共存,即含有37Cl的是37Cl2和SO237Cl2,故选项c符合题意;
(4)a、没有指明反应速率的方向,因此不能作为达到平衡的标志,故a不符合题意;
b、反应前后气体分子数之和不相等,因此压强不变,说明反应达到平衡,故b符合题意;
c、没有指明起始投入量,无法通过浓度的比值,判断是否达到平衡,故c不符合题意;
d、Cl2为黄绿色气体,其余为无色,因此当气体颜色不再改变,说明反应达到平衡,故d符合题意;
(5)300℃时,SOCl2为气体,再加入16gSOCl2,平衡向生成SO2的方向移动,平衡时SO2的质量增大,可以等效为增大压强,SOCl2的转化率降低,平衡时SO2的质量小于原平衡时的2倍,因此平衡时,SO2的质量在7g<m(SO2)<14g。

【题目】已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )

选项 | W | X |
A | 稀硫酸 | Na[Al(OH)4]溶液 |
B | 稀硝酸 | Fe |
C | CO2 | Ca(OH)2溶液 |
D | Cl2 | Fe |
A.AB.BC.CD.D
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:
1 | ||||||||||||||||||
2 | A | B | C | |||||||||||||||
3 | D | E | F | G | H | I | J | K | ||||||||||
4 | M | |||||||||||||||||
(1)在上表用字母标出的12种元素中,化学性质最不活泼的是____(用元素符号表示,下同),属于过渡元素的是___(该空格用表中的字母表示)。
(2)为比较元素A和G的非金属性强弱,用下图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_____,能说明A和G非金属性强弱的化学方程式是______。
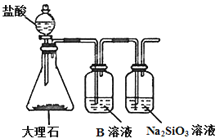
(3)J的氢化物的电子式为____,最高价氧化物对应的水化物的化学式为_________。
【题目】新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高电子层符号为__________,该电子层具有的原子轨道数为______.
②LiBH4由Li+和BH![]() 构成,BH
构成,BH![]() 的立体构型是______,B原子的杂化轨道类型是_______.
的立体构型是______,B原子的杂化轨道类型是_______.
③Li、B元素的电负性由小到大的顺序为_______________________.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+________H-(填“>”“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物. M的部分电离能如下表所示:
I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
738 | 1 451 | 7 733 | 10 540 | 13 630 |
M是________族元素.
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488 pm,Na+半径为102 pm,H-的半径为142pm,NaH的理论密度是________g·cm-3.(仅写表达式,不计算)