题目内容
【题目】原电池的发明是化学对人类的一项重大贡献。
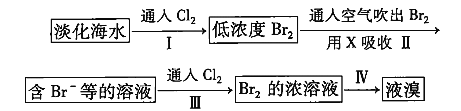
I:如图所示,烧杯中都盛有稀硫酸。
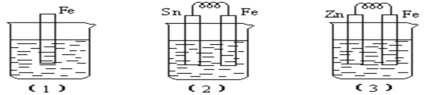
(1)中反应的离子方程式为______________,
(2)中的电极反应:Fe:______________、Sn:______________Sn极附近溶液的pH______________(填增大、减小或不变),
(3)中被腐蚀的金属是______________、比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是______________
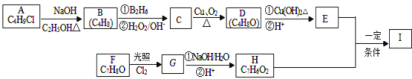
II:依据氧化还原反应:Cu+2Fe3+=2Fe2++Cu2+ 设计的原电池如图所示。
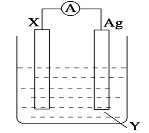
(1)电极 X 的材料是_____;电解质溶液 Y 是_____。
(2)Ag 电极上发生的反应为:_________。
(3)针对上述原电池装置,下列说法中不正确的是_____。(双选)
A.原电池工作时的总反应:Cu+2Fe3+=2Fe2++Cu2+
B.原电池工作时,X 电极流出电子,发生氧化反应
C.原电池工作时,银电极上发生氧化反应
D.原电池工作时,阴离子向 Ag 极移动
【答案】Fe+2H+=Fe2++H2↑ Fe-2e-===Fe2+ 2H++2e-===H2↑ 增大 Zn(锌) (2)>(1)>(3) Cu FeCl3 或Fe2(SO4)3 Fe3++e-===Fe2+ CD
【解析】
Ⅰ.装置(1)发生金属Fe与稀硫酸的置换反应,装置(2)、(3)均为原电池,(2)中Fe为原电池的负极,Sn为原电池的正极,(3)中Zn为原电池的负极,Fe为原电池的正极,形成原电池可加快化学反应速率,据此分析解答问题;
Ⅱ.由反应Cu+2Fe3+===2Fe2++Cu2+可知,Cu失去电子发生氧化反应,Fe3+得到电子发生还原反应,原电池中负极失去电子发生氧化反应,正极得到电子发生还原反应,因此,据此反应设计原电池时,可用Fe3+的盐溶液作电解质,Cu作负极材料,电解反应式为:Cu-2e-===Cu2+,不活泼电极Ag作正极材料,电极上Fe3+得到电子发生还原反应生成Fe2+,电极反应式为Fe3+ +e-= Fe2+,据此分析解答问题。
Ⅰ(1)铁与稀硫酸反应生成硫酸亚铁和氢气,则(1)中反应的离子方程式为Fe+2H+===Fe2++H2↑,故答案为:Fe+2H+===Fe2+ + H2↑;
(2)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。铁的金属性强于锡,则(2)中铁是负极,电极反应为Fe-2e- ===Fe2+ ;Sn是正极,溶液中的氢离子放电,则电极反应式为2H+ + 2e-=== H2↑,所以Sn极附近溶液的pH增大,故答案为:Fe- 2e- ===Fe2+;2H+ + 2e- === H2↑;增大;
(3)锌的金属性强于铁,锌是负极,失去电子,则(3)中被腐蚀的金属是Zn,其电极反应式为Zn-2e-===Zn2+。根据以上分析可知(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是(2)>(1)>(3),故答案为:(2)>(1)>(3);
Ⅱ(1)根据上述分析可知,X为负极,电极材料为Cu,电解质溶液为Fe3+的盐溶液,可以是FeCl3或Fe2(SO4)3溶液,故答案为:Cu;FeCl3或Fe2(SO4)3;
(2)Ag为原电池的正极,电极上Fe3+得到电子发生还原反应生成Fe2+,电极反应式为Fe3+ +e-= Fe2+,故答案为:Fe3+ +e-= Fe2+;
(3)A.由上述分析可知,原电池的总反应为Cu+2Fe3+===2Fe2++Cu2+,A选项正确;
B.原电池工作时,X极为原电池的负极,失去电子,发生氧化反应,B选项正确;
C.原电池工作时,Ag为原电池的正极,电极上Fe3+得到电子发生发生还原反应,C选项错误;
D.原电池中阳离子向正极移动,阴离子向负极移动,该装置X(Cu)极为负极,故阴离子向X(Cu)极移动,D选项错误;
故答案为:CD。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【题目】新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高电子层符号为__________,该电子层具有的原子轨道数为______.
②LiBH4由Li+和BH![]() 构成,BH
构成,BH![]() 的立体构型是______,B原子的杂化轨道类型是_______.
的立体构型是______,B原子的杂化轨道类型是_______.
③Li、B元素的电负性由小到大的顺序为_______________________.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+________H-(填“>”“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物. M的部分电离能如下表所示:
I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
738 | 1 451 | 7 733 | 10 540 | 13 630 |
M是________族元素.
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488 pm,Na+半径为102 pm,H-的半径为142pm,NaH的理论密度是________g·cm-3.(仅写表达式,不计算)
【题目】a、b、c、d是短周期元素,在周期表中的相对位置如图所示.d元素原子核外M层电子数是K层电子数的2倍.下列说法中,错误的是( )
a | b | c |
d |
A. 高温下,a单质可与d的氧化物发生置换反应
B. b的气态氢化物可与其最高价含氧酸反应
C. a、b、c 的最高正化合价等于其所在族序数
D. d的氧化物是制作光导纤维的材料