题目内容
【题目】按要求对下图中两极进行必要的连接并填空:
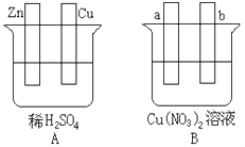
(1)在A图中,使铜片上冒气泡。请加以必要连接,则连接后的装置叫__。电极反应式:锌电极:___;铜电极:__。
(2)在B图中(a,b都为惰性电极),使a极析出铜,则b析出:___。加以必要的连接后,该装置叫___。电极反应式:b极:___。经过一段时间后,停止反应并搅均溶液,溶液的pH值__(升高、降低、不变)。
【答案】原电池 Zn-2e-=Zn2+ 2H++2e-=H2↑ O2 电解池 2H2O -4e-=O2↑+4H+ 降低
【解析】
(1)A中发生的反应为:Zn+2H+=Zn2++H2↑,将Zn和Cu用导线连接,则形成铜锌原电池,Zn作负极,电极反应为:Zn-2e-=Zn2+,Cu作正极,H+在正极得电子,电极反应式为:2H++2e-=H2↑,故答案为:原电池;Zn-2e-=Zn2+;2H++2e-=H2↑;
(2)a、b电极均为惰性电极,电极不能得失电子,则该装置为电解池装置,a极析出铜,则a极为Cu2+得电子,为阴极,电极反应式为:Cu2++2e-=Cu。b极为阳极,水电离出的OH-失电子析出O2,电极反应式为:2H2O -4e-=O2↑+4H+,溶液中氢离子浓度增大,溶液的pH降低,故答案为:O2;电解池;2H2O -4e-=O2↑+4H+;降低。

 口算题天天练系列答案
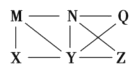
口算题天天练系列答案【题目】已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )

选项 | W | X |
A | 稀硫酸 | Na[Al(OH)4]溶液 |
B | 稀硝酸 | Fe |
C | CO2 | Ca(OH)2溶液 |
D | Cl2 | Fe |
A.AB.BC.CD.D
【题目】新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高电子层符号为__________,该电子层具有的原子轨道数为______.
②LiBH4由Li+和BH![]() 构成,BH
构成,BH![]() 的立体构型是______,B原子的杂化轨道类型是_______.
的立体构型是______,B原子的杂化轨道类型是_______.
③Li、B元素的电负性由小到大的顺序为_______________________.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+________H-(填“>”“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物. M的部分电离能如下表所示:
I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
738 | 1 451 | 7 733 | 10 540 | 13 630 |
M是________族元素.
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488 pm,Na+半径为102 pm,H-的半径为142pm,NaH的理论密度是________g·cm-3.(仅写表达式,不计算)