题目内容
【题目】周期表前四周期的元素A、B、C、D、E、F,原子序数依次增大,A是周期表中原子半径最小的元素,B的基态原子中只有1个未成对电子,C基态原子中有7种不同运动状态的电子,D的最外层电子数是其所处周期数的3倍,E与D同主族,F的一价阳离子最外层有18个电子。回答下列问题:
(1)F在周期表中的位置是_____________
(2)A元素与其他元素形成的含氧酸中,酸根呈三角锥结构的酸是_________,该酸的中心原子的杂化方式为_________
(3)CA3极易溶于水,试从下图中判断CA3溶于水后形成CA3·H2O的合理结构为_____(填字母代号),推理依据是___________
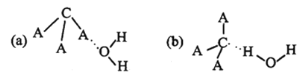
(4)元素B可形成H3BO3,已知H3BO3的电离方程式为H3BO3+2 H2O[B(OH)4]一+H3O+
①基态B、D原子的第一电离能由小到大的顺序为__________(用元素符号表示)
②[B(OH)4]一中B原子的杂化类型为_______________
③写出一种与H3O+互为等电子体的分子的化学式:___________
④H3BO3晶体在热水中的溶解度大于冷水中的溶解度的原因为__________________
【答案】第四周期IB族 H2SO3 sp3 (b) 一水合氨电离产生铵根离子和氢氧根离子 B<O sp3 NH3、PH3、AsH3等 H3BO3晶体中H3BO3分子间存在氢键,加热可以打破该氢键,使得H3BO3分子与水分子间形成氢键,从而溶解度更大
【解析】
A是周期表中原子半径最小的元素,即A为H;C基态原子中7种不同运动状态的电子,即C为N;D的最外层电子数是其所处周期数的3倍,即D为O;因为E与D同主族,且原子序数增大,即D为O、E为S;F的一价阳离子最外层有18个电子,即F的价电子为3d104s1,即F为Cu。B的基态原子中只有1个未成对电子,原子序数小于氮元素,则B为硼,据此解答。
根据以上分析可知A、B、C、D、E、F分别是H、B、N、O、S、Cu。则:
(1)F为Cu,位于第四周期IB族;
(2)能与H形成含氧酸的是B、N、S,酸根呈三角锥结构,应有3个σ键,1个孤电子对,即符合条件的是H2SO3;杂化轨道数等于价层电子对数,SO32-中心原子S的价层电子对数为4,S的杂化类型为sp3;
(3)CA3为NH3,NH3溶于水后,形成NH3·H2O,NH3·H2O为弱碱,其电离方程式为NH3·H2O![]() NH4++OH-,因此合理结构为选项(b);
NH4++OH-,因此合理结构为选项(b);
(4)①同周期从左向右第一电离能增大,因此B的第一电离能小于O;
②根据其离子结构可知,B有4个σ键,无孤电子对,因此B的杂化类型为sp3;
③根据等电子体的定义,H3O+原子总数为4,价电子总数为8,因此符合条件的分子为NH3、PH3、AsH3等;
④H3BO3晶体中H3BO3分子间存在氢键,加热可以打破该氢键,使得H3BO3分子与水分子间形成氢键,从而溶解度更大。

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案