题目内容
【题目】铜及其化合物在生产生活中有广泛应用
(1)工业上以黄铜矿(CuFeS2)为原料,采用火法熔炼工艺生产铜的中间过程会发生反应:2Cu2O+Cu2S![]() 6Cu+SO2↑该反应的氧化剂是________________,验证SO2的方法是________________。
6Cu+SO2↑该反应的氧化剂是________________,验证SO2的方法是________________。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜。温度控制在50℃~60℃的原因有:①加快反应速率;②___________。在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,可生成CuC1沉淀,写出生成CuCl的离子方程式______________。
(3)碱式碳酸铜在有机催化剂、烟火制造和颜料、农药生产中有广泛的应用。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备碱式碳酸铜的流程如下:
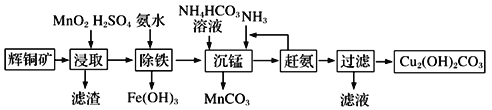
①辉铜矿在浸取前要富集与粉碎,粉碎的好处是___________。
②浸取过程中可得到一种黄色单质,写出浸取时主要反应的化学方程式___________。
③“除铁”这一步反应在25℃进行,加入氨水调节溶液pH为4后,溶液中铜离子最大浓度不超过_________mol/L。(已知Ksp[Cu(OH)2]=2.2×10-20)
【答案】Cu2S和Cu2O将气体通入品红溶液,溶液褪色,加热恢复原色防止H2O2分解2Cu2++2Cl-+SO32-+H2O![]() 2CuCl↓+ SO42-+2H+可提高浸取速率和浸取率Cu2S+2MnO2 +4H2SO4= 2CuSO4+S+2MnSO4+4H2O2.2
2CuCl↓+ SO42-+2H+可提高浸取速率和浸取率Cu2S+2MnO2 +4H2SO4= 2CuSO4+S+2MnSO4+4H2O2.2
【解析】
(1)2Cu2O+Cu2S=6Cu+SO2中,Cu元素化合价由+1价降低到0价,硫元素化合价由-2价升高为+4价,所以氧化剂为Cu2O、Cu2S;验证SO2的方法是将气体通入品红溶液,溶液褪色,加热恢复原色;(2)温度过高,过氧化氢易分解,所以为了防止过氧化氢分解,将温度控制在一定范围内;在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,生成CuCl沉淀,Cu的化合价降低,则S的化合价升高,所以产物中有硫酸根离子生成,所以反应的离子方程式为2Cu2++2Cl-+SO32-+H2O![]() 2CuCl↓+ SO42-+2H+;(3)①酸浸时,通过粉碎矿石或者升高温度或者进行搅拌或都增加酸的浓度,都可以提高浸取速率;②反应物是二氧化锰、硫化铜和硫酸,生成物是S、硫酸铜、硫酸锰,反应的方程式为2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O;③溶液pH=4,c(OH-)=10-10mol/L,则稀释后的溶液中铜离子浓度最大不能超过:
2CuCl↓+ SO42-+2H+;(3)①酸浸时,通过粉碎矿石或者升高温度或者进行搅拌或都增加酸的浓度,都可以提高浸取速率;②反应物是二氧化锰、硫化铜和硫酸,生成物是S、硫酸铜、硫酸锰,反应的方程式为2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O;③溶液pH=4,c(OH-)=10-10mol/L,则稀释后的溶液中铜离子浓度最大不能超过:![]() mol/L=2.2 mol/L。
mol/L=2.2 mol/L。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案