题目内容
【题目】A、X、Y、B、C、D、E、M是前30号元素,原子序数依次增加。A原子是周期表中半径最小的原子;X的基态原子次外层有2个电子,最外层有3个未成对电子;Y原子的2p轨道上有1个电子的自旋方向与其它电子相反;B的价层电子排布式为ns1,C和Y形成的化合物是引起酸雨的主要大气污染物,常温下,D的单质是一种黄绿色的气体;E的+3价离子的3d轨道为半充满状态,M与E元素位于同一周期,且为ⅠB族元素。
(1)B、Y、C分别形成的简单离子的半径由大到小顺序为(填离子符号)_________
(2)元素D基态原子的核外电子排布式为________,其同周期元素中,第一电离能最大的是______(写元素符号)。
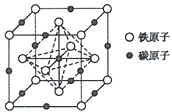
(3)M与D形成的一种化合物的立方晶胞如图所示。
①该化合物的化学式为_______
②此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为_______,其中配位体为_______分子(填“极性”或“非极性”),
(4)基态C原子电子占据最高能级的电子云轮廓图为_______形。将A2C通入ED3溶液中反应的离子方程式为_______
(5)用200mL1mol·L-1的BYA溶液吸收4.48L(标准状况)CY2所得溶液的pH<7,溶液中离子浓度由大到小的顺序为___________________________。
(6)工业上用电化学法治理酸性废液中XY3的原理如图,阴极的电极反应式为_______。

【答案】S2->O2->Na+ 1s22s22p63s23p5或[Ne]3s23p5 Ar CuCl [Cu(NH3)4]2+ 极性 哑铃 H2S+2Fe3+=2Fe2++S↓+2H+ c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) 2NO3-+10e-+12H+=N2↑+6H2O
【解析】
A原子是周期表中半径最小的原子,所以A为H元素;X的基态原子次外层有2个电子,最外层有3个未成对电子,则X的核外电子排布式为1s22s22p3,X为N元素;Y原子的2p轨道上有1个电子的自旋方向与其它电子相反,则Y的2p轨道电子排布式为2p4,所以Y为O元素;常温下,D的单质是一种黄绿色的气体,则D为Cl元素;C和Y形成的化合物是引起酸雨的主要大气污染物,且C的原子序数大于O小于Cl,所以C为S;B的价层电子排布式为ns1,其原子序数大于O且小于S,则其价层电子排布式为3s1,所以B为Na元素;E的+3价离子的3d轨道为半充满状态,则其原子的价层电子排布为3d64s2,为Fe元素;M与E元素位于同一周期,且为ⅠB族元素,则M为Cu元素。
(1)B、Y、C形成的简单离子为Na+、O2-、S2-,离子核外电子层数越多半径越大,电子层数相同,核电荷数越小半径越大,所以离子半径由大到小顺序为:S2->O2->Na+;
(2)Cl元素为17号元素,原子的基态原子核外电子排布式为1s22s22p63s23p5或[Ne]3s23p5;同周期元素中自左至右第一电离能呈增大趋势,Ar元素为该周期最右端元素,且其最外层电子为全满状态,所以第一电离能最大;
(3)①根据均摊法,该晶胞中Cl原子数目为![]() =4,Cu原子数目为4,所以该化合物的化学式为CuCl;
=4,Cu原子数目为4,所以该化合物的化学式为CuCl;
②此化合物的氨水溶液遇到空气则被氧化为深蓝色,说明Cu+被氧化成Cu2+,继而与NH3形成配离子:[Cu(NH3)4]2+;配位体为NH3,其空间构型为三角锥形,正负电荷中心不重合,为极性分子;
(4)基态S原子电子占据最高能级为3p能级,电子云轮廓图为哑铃形;将H2S通入FeCl3溶液中,Fe3+可将-2价的S元素氧化成S,自身被还原成Fe2+,离子方程式为:H2S+2Fe3+=2Fe2++S↓+2H+;
(5)用200mL1mol·L-1的NaOH溶液吸收4.48L(标准状况)即0.2molSO2溶液所得溶液中的溶质为NaHSO3,溶液pH<7,说明HSO3-的电离程度大于水解程度,所以溶液中离子浓度由大到小为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(6)电解时阴极上NO3-发生得电子的还原反应生成N2,则其阴极的反应式为2NO3-+12H++10e-=N2↑+6H2O。

【题目】如图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示.下列选项中正确的是
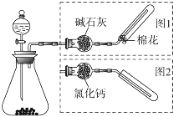
选项 | 发生装置中的药品 | 干燥和集气装置 |
A | 电石和饱和食盐水 | 图2 |
B | 大理石和稀盐酸 | 图1 |
C | 铜和稀硝酸 | 图2 |
D | 氧化钙和浓氨水 | 图1 |
A.AB.BC.CD.D