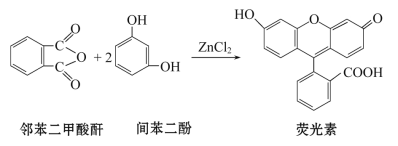
题目内容
【题目】龙葵醛是一种珍贵香料,广泛应用于香料、医药、染料及农药行业。其合成路线如图所示(部分反应产物和反应条件已略去):

已知有机化学反应条件不同,可生成不同的产物:
HX+CH3-CH=CH2 (X为卤素原子)
(X为卤素原子)
回答下列问题:
(1)①的反应类型为___;D中的含氧官能团名称是___。
(2)反应④的化学方程式为___。反应⑤的试剂是___,反应条件是___。
(3)已知A为混合物,设计步骤③、④的目的是___。
(4)龙葵醛与新制Cu(OH)2反应并酸化后得到E,符合下列两个条件的E的同分异构体共有___种。①能发生银镜反应,也能发生水解反应;②是苯环的二元取代产物。写出其中核磁共振氢谱有5种吸收峰的物质的结构简式:___。
(5)参照上述合成路线,设计以2甲基1,3丁二烯为原料,经三步制备2甲基1,4丁二醛( )的路线。__
)的路线。__
【答案】加成反应 羟基 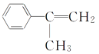 +HBr
+HBr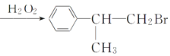 氢氧化钠水溶液 加热 控制官能团的位置,使C物质纯净 6
氢氧化钠水溶液 加热 控制官能团的位置,使C物质纯净 6 ![]() 、
、![]()

【解析】
根据合成路线可知,苯与丙烯发生加成反应,生成![]() ,光照的条件下与Cl2发生取代反应,取代的是侧链上的氢原子后生成A,A发生消去反应生成B, B在H2O2存在的条件下遵循反马氏规则,与 HBr发生加成反应生成C,C在碱性条件下加热,发生水解反应后生成D,D再氧化即可得
,光照的条件下与Cl2发生取代反应,取代的是侧链上的氢原子后生成A,A发生消去反应生成B, B在H2O2存在的条件下遵循反马氏规则,与 HBr发生加成反应生成C,C在碱性条件下加热,发生水解反应后生成D,D再氧化即可得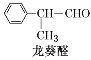 ,由此可知A为
,由此可知A为![]() 或
或![]() ,B为
,B为![]() ,C为
,C为![]() ,D为
,D为![]() ,就此分析回答问题。
,就此分析回答问题。
(1)由分析可知①的反应类型为加成反应;根据D的结构可知D中的含氧官能团为羟基;
(2)反应④是B在H2O2存在的条件下遵循反马氏规则,发生加成反应,方程式为: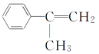 +HBr
+HBr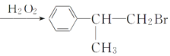 ;反应⑤是卤代烃的水解,反应需要的试剂是氢氧化钠的水溶液,在加热的条件下反应;
;反应⑤是卤代烃的水解,反应需要的试剂是氢氧化钠的水溶液,在加热的条件下反应;
(3)A为混合物,即是![]() 和
和![]() 的混合,发生反应③生成的产物相同,都是
的混合,发生反应③生成的产物相同,都是![]() ,控制条件,可使生成的C为纯净物;
,控制条件,可使生成的C为纯净物;
(4)E是龙葵醛与新制的Cu(OH)2反应后得到的产物,①能发生银镜反应,也能发生水解反应;说明E中存在甲酸某酯的结构;②是苯环的二元取代产物,即含有两个取代基,两个取代基可能是HOOC-、-CH2CH3或者HOOCH2-、-CH3,两个取代基在苯环上有邻、间、对三个位置关系,因此共有2×3=6种同分异构体;其中核磁共振氢谱有5种吸收峰的物质是![]() 和
和![]() ;
;
(5)CH2=CH(CH3)CH=CH2与HBr在H2O2存在下发生反应生成BrCH2CH(CH3)CH2CH2Br,在碱性条件下发生水解生成HOCH2CH(CH3)CH2span>CH2OH,在催化氧化得到![]() ,合成路线为:
,合成路线为:![]()
![]()
![]()
![]()
![]()
![]()
![]() 。
。

【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
【题目】在氮及其化合物的化工生产中,对有关反应的反应原理进行研究有着重要意义。
(1)t℃时,关于N2、NH3的两个反应的信息如下表所示:
化学反应 | 正反应活化能 | 逆反应活化能 | t℃时平衡常数 |
N2(g)+O2(g)=2NO(g) △H>0 | a kJ/mol | b kJ/mol | K1 |
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H<0 | c kJ/mol | d kJ/mol | K2 |
请写出t℃时氨气被一氧化氮氧化生成无毒气体的热化学方程式:______________________,t℃时该反应的平衡常数为__________ (用K1和K2表示)。
(2)工业合成氨的原理为:N2(g)+3H2(g)![]() 2NH3(g)下图甲表示在一定体积的密闭容器中反应时,H2的物质的量浓度随时间的变化。图乙表示在其他条件不变的情况下,起始投料H2与N2的物质的量之比(设为x)与平衡时NH3的物质的量分数的关系。
2NH3(g)下图甲表示在一定体积的密闭容器中反应时,H2的物质的量浓度随时间的变化。图乙表示在其他条件不变的情况下,起始投料H2与N2的物质的量之比(设为x)与平衡时NH3的物质的量分数的关系。

①图甲中0~t1 min内,v(N2)=_____mol·L-1·min-1;b点的v(H2)正_____a点的v(H2)逆(填“大于”“小于”或“等于”)。
②己知某温度下该反应达平衡时各物质均为1 mol,容器体积为1L,保持温度和压强不变,又充入3 mol N2后,平衡________(填“向右移动”“向左移动”或“不移动”)。
(3)①科学家研究出以尿素为动力的燃料电池新技术。用这种电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电。尿素燃料电池结构如图所示,写出负极电极反应式:________________________________________________。
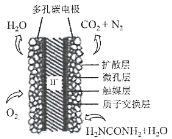
②理论上电池工作时,每消耗标准状况下2.24 L O2时,可产生的电量为________ (法拉第常数为96500C/ mol)。
【题目】![]() 是工业上常用的硫化剂,已知
是工业上常用的硫化剂,已知![]() 中硫元素显
中硫元素显![]() 价,它不稳定,在水中易发生岐化反应,易溶于有机溶剂。实验室常用
价,它不稳定,在水中易发生岐化反应,易溶于有机溶剂。实验室常用![]() 与纯净的氯气制备
与纯净的氯气制备![]() 。反应涉及到的几种物质的熔沸点如下:
。反应涉及到的几种物质的熔沸点如下:
物质 |
|
|
|
|
沸点 | 47 |
| 77 | 137 |
熔点 |
|
|
|
|
实验室利用下列装置制备![]() (部分夹持仪器己略去):
(部分夹持仪器己略去):
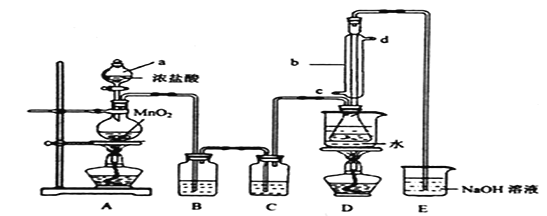
回答下列问题:
(1)装置中b玻璃仪器的名称为_________;写出制备![]() 的化学方程式_________。
的化学方程式_________。
(2)D中采用热水浴加热的原因是 _________,反应结束后从锥形瓶内混合物中分离出产品的方法是______。
(3)实验过程中,若缺少C装置,则发现产品浑浊不清,出现该现象的原因化学方程式表示为______________。
(4)该实始装置设计存在缺陷,你的改进建议是 _________________________________。