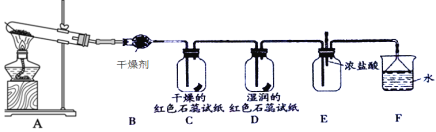
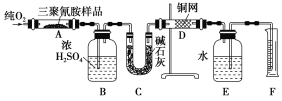
题目内容
【题目】下面是某课外小组从初选后的方铅矿(主要成分PbS,含少量黄铜矿(CuFeS2))中提取硫磺、铜、铅的工艺流程:
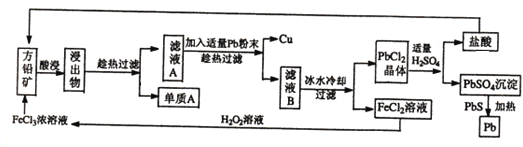
已知:CuFeS2+4FeCl3=2S+5FeCl2+CuCl2 、PbS+2FeCl3=S+PbCl2+2FeCl2
(1)黄铜矿( CuFeS2 )中Fe元素的化合价为 ______ ,提高方铅矿酸浸效率的措施有 ______ (写出两种方法即可)。
(2)过滤过程中用到的玻璃仪器有烧杯、玻璃棒、 ______ ;单质A是 ______ ,在此工艺操作中可循环利用的物质有铅和 ______ 。
(3)在酸性的FeCl2溶液中加入H2O2溶液,其反应的离子方程式为 ______ 。
(4)PbSO4与PbS加热条件下反应的化学方程式为 ______ 。
将沉淀PbSO4与足量的碳酸钠溶液混合,沉淀可转化可转化为PbCO3,写出该反应的平衡常数表达式:K= ______ 。(已知Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14)
(5)铅蓄电池的电极材料分别是Pb和PbO2,电解质溶液为硫酸;铅蓄电池充放电的总反应方程式为:PbO2+Pb+2H2SO4![]() 2PbSO4+2H2O,充电时,铅蓄电池阳极的电极反应式为 ______ 。
2PbSO4+2H2O,充电时,铅蓄电池阳极的电极反应式为 ______ 。
【答案】+2 搅拌,适当提高酸的浓度,加热,将矿石粉碎,延长浸取时间等 漏斗 S 盐酸和氯化铁溶液 2Fe2++H2O2+2H+=2Fe3++2H2O PbSO4+PbS![]() 2Pb+2SO2↑
2Pb+2SO2↑ 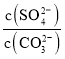 PbSO4-2e-+2H2O=PbO2+SO42-+4H+
PbSO4-2e-+2H2O=PbO2+SO42-+4H+
【解析】
方铅矿中加入氯化铁溶液酸浸,发生氧化还原反应生成S,过滤,单质A为S,滤液A中含有FeCl2、CuCl2以及PbCl2等,加入适量Pb粉可置换出铜,滤液B中含有FeCl2、PbCl2等,经冷水冷却,过滤可得到PbCl2晶体,加入适量硫酸可生成盐酸和硫酸铅,其中盐酸循环使用,硫酸铅中加入PbS发生氧化还原反应生成Pb和二氧化硫气体,FeCl2溶液中加入过氧化氢,发生氧化还原反应生成FeCl3,可循环使用。
(1)CuFeS2中Cu为+2价,S为-2价,则Fe元素的化合价为+2价,方铅矿酸浸为固体和溶液的反应,为提高反应的速率,可加热、增大溶液浓度、增大固体的接触面积或搅拌等,故答案为:+2;搅拌,适当提高酸的浓度,加热,将矿石粉碎,延长浸取时间等;
(2)过滤过程中用到的玻璃仪器有烧杯、玻璃棒、漏斗,由以上分析可知单质A是S,在此工艺操作中可循环利用的物质有铅和盐酸、氯化铁溶液,
故答案为:漏斗;S;盐酸和氯化铁溶液;
(3)FeCl2溶液中加入过氧化氢,发生氧化还原反应生成FeCl3,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)硫酸铅中加入PbS发生氧化还原反应生成Pb和二氧化硫气体,反应的化学方程式为PbSO4+PbS![]() 2Pb+2SO2↑,PbSO4转化为PbCO3的反应为PbSO4(s)+CO32-
2Pb+2SO2↑,PbSO4转化为PbCO3的反应为PbSO4(s)+CO32-![]() PbCO3(s)+SO42-,该反应平衡常数表达式K=
PbCO3(s)+SO42-,该反应平衡常数表达式K=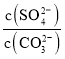 ,
,
故答案为:PbSO4+PbS![]() 2Pb+2SO2↑;
2Pb+2SO2↑;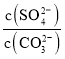 ;
;
(5)充电时,阳极上PbSO4失电子发生氧化反应,电极反应式为PbSO4-2e-+2H2O=PbO2+SO42-+4H+,
故答案为:PbSO4-2e-+2H2O=PbO2+SO42-+4H+。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案