题目内容
【题目】某化合物的结构式(键线式)及球棍模型如下:

该有机物分子的核磁共振氢谱图如下(单位是ppm)。下列关于该有机物的叙述正确的是( )

A.该有机物属于芳香化合物
B.键线式中的Et代表的基团为—CH3
C.该有机物不同化学环境的氢原子有8种
D.该有机物的分子式为C9H10O4
【答案】C
【解析】
A. 含有苯环的有机物为芳香化合物;
B. 根据球棍模型判断Et代表的基团;
C. 根据核磁共振氢谱图可确定不同化学环境的氢原子;
D. 根据键线式判断分子式。
A. 该有机物结构中不存在苯环,不属于芳香化合物,A项错误;
B. 由球棍模型可知Et代表的基团为-CH2CH3,B项错误;
C. 根据核磁共振氢谱图可确定该有机物存在8中不同环境的氢原子,C项正确;
D. 该有机物的分子式为C9H12O4,D项错误;
答案选C。

【题目】CO、SO2是大气污染气体,利用化学反应是治理污染的重要方法。
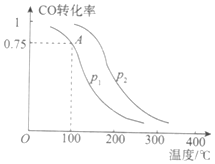
Ⅰ.甲醇可以补充和部分替代石油燃料,缓解能源紧张,利用CO可以合成甲醇:CO+2H2![]() CH3OH(g)。一定条件下,在容积为VL的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。一定条件下,在容积为VL的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示。
(1)下列能说明反应达到平衡状态的是_______(填序号)。
①v逆(CO)=2v正(H2)
②c(CO)=c(CH3OH)
③混合气体的平均相对分子质量不变
④单位时间内生成2n mol H2的同时生成n mol CH3OH
(2)该反应在A点的平衡常数K_________(用a和V表示)。
(3)写出既能增大v(CO)又能提高CO转化率的一项措施:________。
Ⅱ.某学习小组以SO2为原料,采用电化学方法制取硫酸。
(4)原电池原理:该小组设计的原理示意图(如图1所示),写出该电池正极的电极反应式_______。
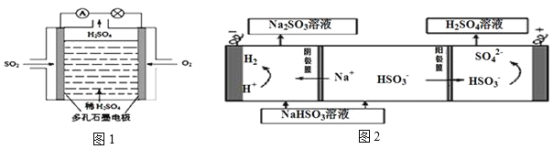
(5)电解原理:该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸(原理如图2所示)。写出开始电解时阳极的电极反应式_______。
Ⅲ.硫代硫酸钠(Na2S2O3)俗称大苏打,有着广泛的用途。用SO2可制Na2S2O3。某小组同学制备、预测并探究硫代硫酸钠的性质(反应均在溶液中进行)。
预测 | 实验操作 | 实验现象 | |
探究1 | Na2S2O3溶液呈碱性 | 把pH试纸放在玻璃片上,用玻璃棒蘸取溶液滴在试纸上 | pH=8 |
探究2 | Na2S2O3具有还原性 | 向新制氯水中滴加Na2S2O3溶液 | 黄绿色颜色变浅,甚至褪去 |
(6)分析SO2能制备Na2S2O3的理论依据是_________。
(7)用离子方程式表示Na2S2O3溶液具有碱性的原因_________。
(8)探究2反应的离子方程式为_________。
【题目】在氮及其化合物的化工生产中,对有关反应的反应原理进行研究有着重要意义。
(1)t℃时,关于N2、NH3的两个反应的信息如下表所示:
化学反应 | 正反应活化能 | 逆反应活化能 | t℃时平衡常数 |
N2(g)+O2(g)=2NO(g) △H>0 | a kJ/mol | b kJ/mol | K1 |
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H<0 | c kJ/mol | d kJ/mol | K2 |
请写出t℃时氨气被一氧化氮氧化生成无毒气体的热化学方程式:______________________,t℃时该反应的平衡常数为__________ (用K1和K2表示)。
(2)工业合成氨的原理为:N2(g)+3H2(g)![]() 2NH3(g)下图甲表示在一定体积的密闭容器中反应时,H2的物质的量浓度随时间的变化。图乙表示在其他条件不变的情况下,起始投料H2与N2的物质的量之比(设为x)与平衡时NH3的物质的量分数的关系。
2NH3(g)下图甲表示在一定体积的密闭容器中反应时,H2的物质的量浓度随时间的变化。图乙表示在其他条件不变的情况下,起始投料H2与N2的物质的量之比(设为x)与平衡时NH3的物质的量分数的关系。

①图甲中0~t1 min内,v(N2)=_____mol·L-1·min-1;b点的v(H2)正_____a点的v(H2)逆(填“大于”“小于”或“等于”)。
②己知某温度下该反应达平衡时各物质均为1 mol,容器体积为1L,保持温度和压强不变,又充入3 mol N2后,平衡________(填“向右移动”“向左移动”或“不移动”)。
(3)①科学家研究出以尿素为动力的燃料电池新技术。用这种电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电。尿素燃料电池结构如图所示,写出负极电极反应式:________________________________________________。
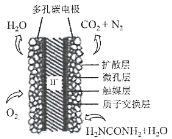
②理论上电池工作时,每消耗标准状况下2.24 L O2时,可产生的电量为________ (法拉第常数为96500C/ mol)。