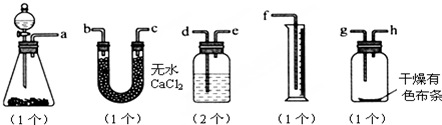
题目内容
6.下列说法正确的是( )| A. | 淀粉和纤维素的通式都是(C6H10O5)n,是同分异构体 | |
| B. | 向鸡蛋清溶液中加入(NH4)2SO4饱和溶液,有沉淀析出,再加水沉淀不溶解 | |
| C. | 油脂、糖类和蛋白质是食物含有的主要营养物质,它们都是高分子化合物 | |
| D. | 可以用新制的Cu(OH)2悬浊液检验患者的尿液中是否含糖 |
分析 A.纤维素和淀粉的化学成分均为(C6H10O5)n,但两者的n不同;
B.蛋白质遇到非重金属盐时会发生盐析;
C.高分子化合物是相对分子质量高达几十万甚至上百万的有机物;
D.醛可以和氢氧化铜悬浊液反应生成砖红色沉淀,据此检验是否患有糖尿病.
解答 解:A.纤维素和淀粉的化学成分均为(C6H10O5)n,但两者的n不同,所以两者的分子式不同,不是同分异构体,故A错误;
B.向鸡蛋清溶液中加入(NH4)2SO4饱和溶液,有沉淀析出,再加水沉淀溶解,故B错误;
C.油脂属于酯,不是高分子化合物,故C错误;
D.患者的尿液中如果含糖,则会和新制的Cu(OH)2悬浊液反应出现砖红色沉淀,故D正确.
故选D.
点评 本题涉及有机物的同分异构现象、葡萄糖的性质、高分子化合物的特点以及蛋白质的性质等知识,属于综合知识的考查,难度中等.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
13.将10.4gNa20和Na2O2的固体混合物投入到水中.充分反应后收集到02的质量为 1.6g,则混合物中Na20的质量分数为( )
| A. | 20% | B. | 75% | C. | 25% | D. | 66% |
17.下列离子方程式正确的是( )
| A. | 氢氧化钡溶液中滴加硫酸氢钠至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| B. | 饱和碳酸钠溶液中通入二氧化碳后溶液变浑浊:2Na++CO32-+CO2+H2O=2NaHCO3↓ | |
| C. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O | |
| D. | 5.6g Fe与200mL2.0mol/L HNO3溶液充分反应:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O |
14.厨房中常用到食盐、食醋、纯碱、小苏打、淀粉等物质,利用这些物质你不能完成的实验是( )
| A. | 检验鸡蛋壳能否溶解在酸中 | B. | 检验食盐中是否加碘 | ||
| C. | 除去热水瓶内壁上的水垢 | D. | 鉴别食盐和纯碱 |
18.A、B、C、D、E是原子序数依次增大的短周期元素,A可以与氢组成气态氢化物分子中氢元素的质量百分含量为最高的物质,C是地壳中含量最高的金属,D与C可以形成C2D3型的化合物.
(1)C的离子结构示意图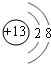 E在周期表中的位置第三周期第VIIA族
E在周期表中的位置第三周期第VIIA族
(2)A与氢元素组成的化合物分子甲中含有8个原子,与D同主族的某元素与氢组成的化合物乙与甲的电子数相等,则乙的电子式为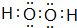
(3)B的最简单气态氢化物丙的水溶液显碱性
①在微电子工业中丙的水溶液与乙反应的产物不污染环境,其相互反应的化学方程式为2NH3•H2O+3H2O2=N2↑+8H2O
②一定条件下,丙在固定体积的密闭容器中分解(△H>0)并到达平衡,仅改变下列条件X平衡体系中随X递增Y递减的是ab
(4)C2D3能否通过复分解反应制取不能原因Al3+、S2-在水溶液中发生强烈双水解生成Al(OH)3与H2S
(5)A与D形成的液态化合物AD20.2mol在O2中完全燃烧,生成两种稳定的气态氧化物,在298K时放出热量215kJ写出表示该化合物燃烧热的热化学方程式:CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol.
(1)C的离子结构示意图
 E在周期表中的位置第三周期第VIIA族
E在周期表中的位置第三周期第VIIA族(2)A与氢元素组成的化合物分子甲中含有8个原子,与D同主族的某元素与氢组成的化合物乙与甲的电子数相等,则乙的电子式为
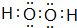
(3)B的最简单气态氢化物丙的水溶液显碱性
①在微电子工业中丙的水溶液与乙反应的产物不污染环境,其相互反应的化学方程式为2NH3•H2O+3H2O2=N2↑+8H2O
②一定条件下,丙在固定体积的密闭容器中分解(△H>0)并到达平衡,仅改变下列条件X平衡体系中随X递增Y递减的是ab
| 选项 | a | b | c | d |
| X | 温度 | 加入氢气 | 加入丙 | 温度 |
| Y | n(丙) | 丙的转化率 | n(生成物) | n(H2) |
(5)A与D形成的液态化合物AD20.2mol在O2中完全燃烧,生成两种稳定的气态氧化物,在298K时放出热量215kJ写出表示该化合物燃烧热的热化学方程式:CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol.
16.用NA代表阿伏加德罗常数的值,下列有关说法正确的是( )
| A. | 78g过氧化钠晶体中,含2NA个阴离子 | |
| B. | 1L 0.1 mol/L醋酸溶液中含有的氢离子数为0.1NA | |
| C. | 在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA | |
| D. | 常温下16g O2与O3的混合气体中含氧原子数为NA |
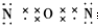 ,其空间构型是直线形,由此可知它是非极性(填“极性”或“非极性”)分子.
,其空间构型是直线形,由此可知它是非极性(填“极性”或“非极性”)分子.