题目内容
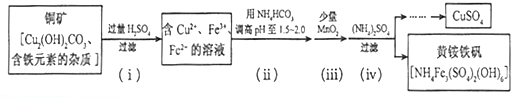
13.将10.4gNa20和Na2O2的固体混合物投入到水中.充分反应后收集到02的质量为 1.6g,则混合物中Na20的质量分数为( )| A. | 20% | B. | 75% | C. | 25% | D. | 66% |
分析 根据题中信息可知,Na2O2与水反应得到的氧气的量可以计算过氧化钠的质量,可以求出氧化钠质量,根据质量分数等于氧化钠质量和混合物质量的比值进行计算即可.
解答 解:设原固体混合物中Na2O2的物质的量为xmolg,已知2H2O+2Na2O2=4NaOH+O2↑,H2O+Na2O=2NaOH;则Na2O2与水反应生成的氧气为0.5xmol,所以0.5x×32g/mol=1.6g,x=0.1mol,质量是7.8g,所以氧化钠的质量是10.4g-7.8g=2.6g,所以混合物中Na20的质量分数为$\frac{2.6g}{10.4g}×100%$≈25%.故选C.
点评 本题考查了Na2O和Na2O2与水的反应,同时涉及了化学反应中根据化学方程式的有关计算,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
4.下列各组固体混合物中,能用过滤的操作方法进行分离的是( )
| A. | NaCl和NaNO3 | B. | CaCO3和MnO2 | C. | CaCO3和Na2CO3 | D. | NaOH和NaNO3 |
5.以苯酚为原料合成对羟基苯乙酮的原理如图:
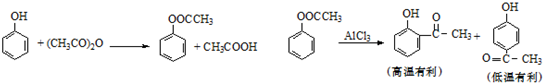
(1)乙酸苯酚酯制备:
将9.4g苯酚溶解在60mL10%的氢氧化钠溶液中,加入30g碎冰块,然后加入13.0g乙酸酐,搅拌5min.将反应后混合物倾入分液漏斗中,加入约4mL CCl4.将有机相用试剂X和水洗涤然后无水CaCl2干燥,蒸馏收集193-197℃馏分.
①用碎冰块代替水可能的原因是:该反应是放热反应,碎冰温度低有利于酯的生成.
②乙酸酐过量的目的是:提高苯酚的转化率.
③有机相先用试剂X洗涤,X可能是Na2CO3或NaHCO3溶液.
(2)对羟基苯乙酮的制备:
将乙酰苯酚6.8g,硝基苯20mL 放在三口烧瓶中,搅拌下加入无水AlCl3 11g(此时放热),加完后控制合适的温度,维持一定时间.然后冷却,倾入冰水中,用6mol/L HCl酸化分出硝基苯层,水层用氯仿萃取,蒸出氯仿得粗品.
①硝基苯的作用是作溶剂.
②乙酸苯酚重排为对羟基苯乙酮反应条件对收率的影响关系如表
适宜的温度是20~25;反应时间是180min.

(1)乙酸苯酚酯制备:
将9.4g苯酚溶解在60mL10%的氢氧化钠溶液中,加入30g碎冰块,然后加入13.0g乙酸酐,搅拌5min.将反应后混合物倾入分液漏斗中,加入约4mL CCl4.将有机相用试剂X和水洗涤然后无水CaCl2干燥,蒸馏收集193-197℃馏分.
①用碎冰块代替水可能的原因是:该反应是放热反应,碎冰温度低有利于酯的生成.
②乙酸酐过量的目的是:提高苯酚的转化率.
③有机相先用试剂X洗涤,X可能是Na2CO3或NaHCO3溶液.
(2)对羟基苯乙酮的制备:
将乙酰苯酚6.8g,硝基苯20mL 放在三口烧瓶中,搅拌下加入无水AlCl3 11g(此时放热),加完后控制合适的温度,维持一定时间.然后冷却,倾入冰水中,用6mol/L HCl酸化分出硝基苯层,水层用氯仿萃取,蒸出氯仿得粗品.
①硝基苯的作用是作溶剂.
②乙酸苯酚重排为对羟基苯乙酮反应条件对收率的影响关系如表
| 反应温度/℃ | 反应时间(min) | 收率 |
| 30~35 | 180 | 10.0 |
| 20~25 | 60 | 18.0 |
| 20~25 | 120 | 26.0 |
| 20~25 | 180 | 58.5 |
6.下列说法正确的是( )
| A. | 淀粉和纤维素的通式都是(C6H10O5)n,是同分异构体 | |
| B. | 向鸡蛋清溶液中加入(NH4)2SO4饱和溶液,有沉淀析出,再加水沉淀不溶解 | |
| C. | 油脂、糖类和蛋白质是食物含有的主要营养物质,它们都是高分子化合物 | |
| D. | 可以用新制的Cu(OH)2悬浊液检验患者的尿液中是否含糖 |

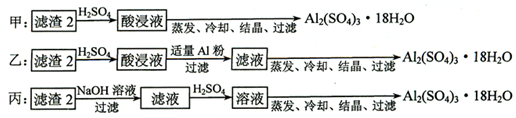
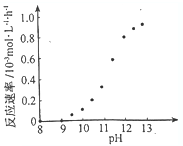 (1)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层.
(1)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层.