题目内容
1.已知N、P同属于元素周期表的第VA族元素,N在第2周期,P在第3周期.NH3分子呈三角锥形,氮原子位于锥顶,三个氢原子位于锥底,N-H键间的夹角是107°.(1)PH3分子与NH3分子的构型关系是相似(填“相同”或“相似”或“不相似”),P-H有极性(填“有”或“无”),PH3分子有极性(填“有”或“无”).
(2)NH3与PH3相比,热稳定性NH3更强(填化学式).
(3)NH3、PH3在常温、常压下都是气体,但NH3比PH3易液化,其主要原因是D.
A.键的极性N-H比P-H强
B.分子的极性NH3比PH3强
C.相对分子质量PH3比NH3大
D.NH3分子之间存在特殊的分子间作用力
(4)笑气(N2O)是一种麻醉剂,有关理论认为N2O与CO2分子具有相似的结构(包括电子式).已知N2O分子中氮原子只与氧原子相连,N2O的电子式为
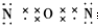 ,其空间构型是直线形,由此可知它是非极性(填“极性”或“非极性”)分子.
,其空间构型是直线形,由此可知它是非极性(填“极性”或“非极性”)分子.
分析 (1)PH3分子与NH3分子中P、N原子价层电子对个数都是4且都含有一个孤电子对,所以其空间构型相同为三角锥形;不同非金属元素之间易错非极性键,正负电荷重心不重合的分子为极性分子;
(2)元素的非金属性越强,其氢化物的稳定性越强;
(3)NH3比PH3易液化,是由于NH3分子间能形成氢键,与键的极性、相对分子质量无关;
(4)N2O与CO2分子具有相似的结构,且N2O分子中氮原子只与氧原子相连,根据二氧化碳电子式书写一氧化二氮电子式;二者是等电子体,其空间构型相同,正负电荷重心重合的分子为非极性分子.
解答 解:(1)PH3分子与NH3分子中P、N原子价层电子对个数都是4且都含有一个孤电子对,所以其空间构型相同为三角锥形;不同非金属元素之间易错非极性键,正负电荷重心不重合的分子为极性分子,P-H之间存在极性键,PH3分子结构不对称,正负电荷重心不重合,为极性分子,故答案为:相似;有;有;
(2)非金属性N>P,所以氨气的稳定性较强,故答案为:NH3;
(3)NH3分子之间存在氢键,PH3分子之间为范德华力,氢键作用比范德华力强,故NH3比PH3易液化,NH3沸点比PH3高,与键的极性、相对分子质量无关,故选D;
(4)N2O与CO2分子具有相似的结构,且N2O分子中氮原子只与氧原子相连,根据二氧化碳电子式书写一氧化二氮电子式为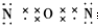 ;二者是等电子体,其空间构型相同,所以一氧化二氮是直线形分子,正负电荷重心重合的分子为非极性分子,结构对称为非极性分子,
;二者是等电子体,其空间构型相同,所以一氧化二氮是直线形分子,正负电荷重心重合的分子为非极性分子,结构对称为非极性分子,
故答案为: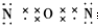 ;直线形;非极性.
;直线形;非极性.
点评 本题考查物质结构和性质,涉及微粒空间构型判断、等电子体、氢键、物质稳定性等知识点,为高频考点,明确等电子体结构、性质特点及价层电子对互斥理论内涵即可解答,难点是价层电子对中孤电子对计算方法.

 一定温度下,在1L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列叙述正确的是( )
一定温度下,在1L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列叙述正确的是( )| A. | l0 s后,该反应停止进行反应 | B. | 反应的化学方程式为2X(g)+2Y(g)?Z(g) | ||
| C. | 0~10s内,v (Z)=0.16moL/(L•s) | D. | 0~10s内,ν(X)=ν(Y)=0.04mol/(L•s) |
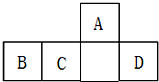 短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中B所处的周期序数与族序数相等.下列判断错误的是( )
短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中B所处的周期序数与族序数相等.下列判断错误的是( )| A. | 原子半径:B>C>A | |
| B. | 最高价氧化物对应水化物的酸性:C<D | |
| C. | 含B元素的盐溶液一定显酸性 | |
| D. | 最简单气态氢化物的热稳定性:A>C |
| A. | 46gNO2气体中含有原子数为3NA | |
| B. | 标准状况下22.4LH2中含质子数为2NA | |
| C. | 13gZn与足量盐酸反应可放出氢气4.48L | |
| D. | 标准状况下,11.2LN2和 CO的混和气体物质的量为0.5mol |
| A. | 淀粉和纤维素的通式都是(C6H10O5)n,是同分异构体 | |
| B. | 向鸡蛋清溶液中加入(NH4)2SO4饱和溶液,有沉淀析出,再加水沉淀不溶解 | |
| C. | 油脂、糖类和蛋白质是食物含有的主要营养物质,它们都是高分子化合物 | |
| D. | 可以用新制的Cu(OH)2悬浊液检验患者的尿液中是否含糖 |
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3-NO3- OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有A中放出无色气体,只有C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:BKNO3,DCuSO4.
(2)在A溶液中加入少量澄清石灰水,观察到的现象为产生白色沉淀
(3)将含lmol A的溶液与含l mol E的溶液反应后蒸干,仅得到一种化合物,该化合物化学式为Na2CO3.反应的离子方程式是HCO3-+OH-=H2O+CO32-.
(4)C常用作净水剂,用离子方程式表示其净水原理Al3++3H2O?Al(OH)3(胶体)+3H+.
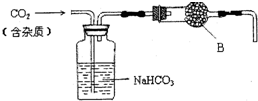 实验室中的CO2气体用大理石和稀盐酸反应制取,并用如图装置进行提纯和干燥.
实验室中的CO2气体用大理石和稀盐酸反应制取,并用如图装置进行提纯和干燥. 如图所示物质的转化关系中,A是一种固体单质,E是一种白色沉淀.请回答下列问题:
如图所示物质的转化关系中,A是一种固体单质,E是一种白色沉淀.请回答下列问题: