题目内容
11.已知X、Y、Z、L四种元素是组成蛋白质的基础元素,它们的原子序数依次增大.M元素的最高价氧化物是沙子的主要成分.回答下列问题:(1)L元素的符号O.
(2)Y、Z、L、M四种元素原子半径由大到小的顺序是Si>C>N>O(用元素符号表示).
(3)比较Y与M的最高价氧化物对应水化物酸性的强弱H2CO3>H2SiO3(用化学式表示).
(4)A分子由X、Z两元素组成,作为运送飞船的火箭燃料,常温下是一种液态化合物.已知A的相对分子质量为32,A分子中X与Z的原子个数比为2:1.常温下,1mol液态化合物A与液态双氧水反应反应生成氮气和水放出641.75kJ热量,写出该反应的热化学反应方程式N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-641.75kJ/mol.
分析 X、Y、Z、L四种元素是组成蛋白质的基础元素,它们的原子序数依次增大,则X为H元素,Y为C元素,Z为N元素,L为O元素,M元素的最高价氧化物是沙子的主要成分,则M为Al元素.
(1)由上述分析可知,L为O元素;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(3)非金属性越强,最高价含氧酸的酸性越强;
(4)A分子由H、N两元素组成,A的相对分子质量为32,A分子中X与Z的原子个数比为2:1,则A为N2H4,注明物质的聚集状态与反应热书写热化学方程式.
解答 解:X、Y、Z、L四种元素是组成蛋白质的基础元素,它们的原子序数依次增大,则X为H元素,Y为C元素,Z为N元素,L为O元素,M元素的最高价氧化物是沙子的主要成分,则M为Al元素.
(1)由上述分析可知,L为O元素,故答案为:O;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Si>C>N>O,故答案为:Si>C>N>O;
(3)非金属性C>Si,非金属性越强,最高价含氧酸的酸性越强,故酸性:H2CO3>H2SiO3,故答案为:H2CO3>H2SiO3;
(4)A分子由H、N两元素组成,A的相对分子质量为32,A分子中X与Z的原子个数比为2:1,则A为N2H4,常温下,1mol液态化合物N2H4与液态双氧水反应反应生成氮气和水放出641.75kJ热量,该反应的热化学反应方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-641.75kJ/mol,
故答案为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-641.75kJ/mol.
点评 本题考查元素推断、元素周期律、热化学方程式书写等,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目
2.在一定条件下,对于密闭容器中的反应:N2+3H2?2NH3,下列说法正确的是( )
| A. | 增加N2的量,可以加快反应速率 | |
| B. | 当N2和H2全部转化为NH3时,反应才达到最大限度 | |
| C. | 达到平衡时,H2和NH3的浓度比一定为3:2 | |
| D. | 分别用N2和NH3来表示该反应的速率时,数值大小相同 |
19.W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18,下列说法正确的是( )
| A. | 氢化物稳定性:Y>Z | |
| B. | XW3与WZ相遇,产生大量白烟 | |
| C. | 氧化物的水化物的酸性:Y<Z | |
| D. | X与Z不能同时存在于同一离子化合物中 |
6.下列说法正确的是( )
| A. | 淀粉和纤维素的通式都是(C6H10O5)n,是同分异构体 | |
| B. | 向鸡蛋清溶液中加入(NH4)2SO4饱和溶液,有沉淀析出,再加水沉淀不溶解 | |
| C. | 油脂、糖类和蛋白质是食物含有的主要营养物质,它们都是高分子化合物 | |
| D. | 可以用新制的Cu(OH)2悬浊液检验患者的尿液中是否含糖 |
20.空气是人类生存所必需的重要资源.为改善空气质量而启动的“蓝天工程”得到了全民的支持.下列措施不属于“蓝天工程”建设的是( )
| A. | 推广使用燃煤脱硫技术,在燃煤中加入适量石灰石,可减少废气中的SO2 | |
| B. | 实施绿化工程,防治扬尘污染 | |
| C. | 研制开发燃料电池汽车,消除机动车尾气污染 | |
| D. | 加高工厂的烟囱,使烟尘和废气远离地表 |

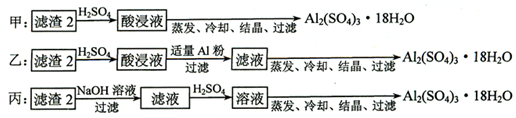
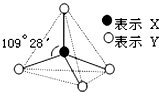 甲、乙、丙、丁、戊具有如图所示的结构或结构单元,图中四面体外可能有的部分未画出,只有实线表示共价键,X、Y可同可不同.
甲、乙、丙、丁、戊具有如图所示的结构或结构单元,图中四面体外可能有的部分未画出,只有实线表示共价键,X、Y可同可不同.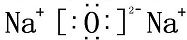 H2O2
H2O2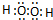 NH4Cl
NH4Cl .
.