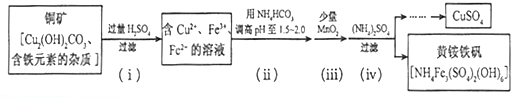
题目内容
17.下列离子方程式正确的是( )| A. | 氢氧化钡溶液中滴加硫酸氢钠至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| B. | 饱和碳酸钠溶液中通入二氧化碳后溶液变浑浊:2Na++CO32-+CO2+H2O=2NaHCO3↓ | |
| C. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O | |
| D. | 5.6g Fe与200mL2.0mol/L HNO3溶液充分反应:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O |
分析 A.硫酸氢钠溶液中滴入氢氧化钡溶液至中性,反应生成硫酸钡、硫酸钠和水;
B.饱和碳酸钠溶液中通入二氧化碳后溶液生成碳酸氢钠沉淀,变浑浊;
C.碳酸氢铵溶液中加入过量氢氧化钠溶液生成碳酸钠、一水合氨;
D.根据反应物的量的关系判断.
解答 解:A.硫酸氢钠溶液中滴入氢氧化钡溶液至中性,反应生成硫酸钡、硫酸钠和水,反应的离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故A错误;
B.饱和碳酸钠溶液中通入二氧化碳后溶液生成碳酸氢钠沉淀,变浑浊,反应为2Na++CO32-+CO2+H2O=2NaHCO3↓,故B正确;
C.碳酸氢铵溶液中加入过量氢氧化钠溶液生成碳酸钠、一水合氨,反应的离子方程式为NH4++HCO3-+OH-=CO32-+NH3•H2O,故C错误;
D.5.6g Fe的物质的量为0.1mol,200mL2.0mol/L HNO3的物质的量为0.4mol,发生Fe+NO3-+4H+=Fe3++NO↑+2H2O,故D错误.
故选B.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的化学反应及离子反应的书写方法为解答的关键,侧重氧化还原反应及与量有关的离子反应考查,选项D为易错点,题目难度中等.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
4.下列各组固体混合物中,能用过滤的操作方法进行分离的是( )
| A. | NaCl和NaNO3 | B. | CaCO3和MnO2 | C. | CaCO3和Na2CO3 | D. | NaOH和NaNO3 |
5.以苯酚为原料合成对羟基苯乙酮的原理如图:
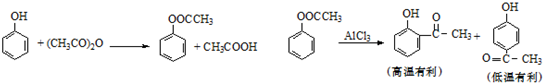
(1)乙酸苯酚酯制备:
将9.4g苯酚溶解在60mL10%的氢氧化钠溶液中,加入30g碎冰块,然后加入13.0g乙酸酐,搅拌5min.将反应后混合物倾入分液漏斗中,加入约4mL CCl4.将有机相用试剂X和水洗涤然后无水CaCl2干燥,蒸馏收集193-197℃馏分.
①用碎冰块代替水可能的原因是:该反应是放热反应,碎冰温度低有利于酯的生成.
②乙酸酐过量的目的是:提高苯酚的转化率.
③有机相先用试剂X洗涤,X可能是Na2CO3或NaHCO3溶液.
(2)对羟基苯乙酮的制备:
将乙酰苯酚6.8g,硝基苯20mL 放在三口烧瓶中,搅拌下加入无水AlCl3 11g(此时放热),加完后控制合适的温度,维持一定时间.然后冷却,倾入冰水中,用6mol/L HCl酸化分出硝基苯层,水层用氯仿萃取,蒸出氯仿得粗品.
①硝基苯的作用是作溶剂.
②乙酸苯酚重排为对羟基苯乙酮反应条件对收率的影响关系如表
适宜的温度是20~25;反应时间是180min.

(1)乙酸苯酚酯制备:
将9.4g苯酚溶解在60mL10%的氢氧化钠溶液中,加入30g碎冰块,然后加入13.0g乙酸酐,搅拌5min.将反应后混合物倾入分液漏斗中,加入约4mL CCl4.将有机相用试剂X和水洗涤然后无水CaCl2干燥,蒸馏收集193-197℃馏分.
①用碎冰块代替水可能的原因是:该反应是放热反应,碎冰温度低有利于酯的生成.
②乙酸酐过量的目的是:提高苯酚的转化率.
③有机相先用试剂X洗涤,X可能是Na2CO3或NaHCO3溶液.
(2)对羟基苯乙酮的制备:
将乙酰苯酚6.8g,硝基苯20mL 放在三口烧瓶中,搅拌下加入无水AlCl3 11g(此时放热),加完后控制合适的温度,维持一定时间.然后冷却,倾入冰水中,用6mol/L HCl酸化分出硝基苯层,水层用氯仿萃取,蒸出氯仿得粗品.
①硝基苯的作用是作溶剂.
②乙酸苯酚重排为对羟基苯乙酮反应条件对收率的影响关系如表
| 反应温度/℃ | 反应时间(min) | 收率 |
| 30~35 | 180 | 10.0 |
| 20~25 | 60 | 18.0 |
| 20~25 | 120 | 26.0 |
| 20~25 | 180 | 58.5 |
12. 一定温度下,在1L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列叙述正确的是( )
一定温度下,在1L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列叙述正确的是( )
 一定温度下,在1L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列叙述正确的是( )
一定温度下,在1L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列叙述正确的是( )| A. | l0 s后,该反应停止进行反应 | B. | 反应的化学方程式为2X(g)+2Y(g)?Z(g) | ||
| C. | 0~10s内,v (Z)=0.16moL/(L•s) | D. | 0~10s内,ν(X)=ν(Y)=0.04mol/(L•s) |
2.在一定条件下,对于密闭容器中的反应:N2+3H2?2NH3,下列说法正确的是( )
| A. | 增加N2的量,可以加快反应速率 | |
| B. | 当N2和H2全部转化为NH3时,反应才达到最大限度 | |
| C. | 达到平衡时,H2和NH3的浓度比一定为3:2 | |
| D. | 分别用N2和NH3来表示该反应的速率时,数值大小相同 |
9.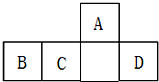 短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中B所处的周期序数与族序数相等.下列判断错误的是( )
短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中B所处的周期序数与族序数相等.下列判断错误的是( )
 短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中B所处的周期序数与族序数相等.下列判断错误的是( )
短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中B所处的周期序数与族序数相等.下列判断错误的是( )| A. | 原子半径:B>C>A | |
| B. | 最高价氧化物对应水化物的酸性:C<D | |
| C. | 含B元素的盐溶液一定显酸性 | |
| D. | 最简单气态氢化物的热稳定性:A>C |
6.下列说法正确的是( )
| A. | 淀粉和纤维素的通式都是(C6H10O5)n,是同分异构体 | |
| B. | 向鸡蛋清溶液中加入(NH4)2SO4饱和溶液,有沉淀析出,再加水沉淀不溶解 | |
| C. | 油脂、糖类和蛋白质是食物含有的主要营养物质,它们都是高分子化合物 | |
| D. | 可以用新制的Cu(OH)2悬浊液检验患者的尿液中是否含糖 |
7.关于胶体和溶液的区别,下列叙述中正确的是( )
| A. | 溶液呈电中性,胶体带有电荷 | |
| B. | 溶液中溶质微粒一定带电,胶体中分散质粒子带电,且通电后,溶质粒子向两极移动,胶体粒子向一极移动 | |
| C. | 溶液中溶质粒子有规律运动,而胶体粒子无规律运动 | |
| D. | 溶液中通过一束光线时无特殊现象,胶体中通过一束光时有明显的光带 |
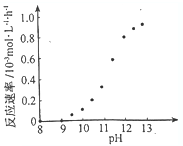 (1)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层.
(1)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层.