题目内容
【题目】钛是一种性能非常优越的金属,21世纪将是钛的世纪。
(1)TiO2薄膜中掺杂铬能显著提高光催化活性。基态Cr原子的核外电子排布式为____。
(2)四乙醇钛能增加橡胶在金属表面的粘附性。其制备原理如下:TiCl4+4CH3CH2OH+4NH3=Ti(OCH2CH3)4+4NH4Cl
①Ti(OCH2CH3)4可溶于有机溶剂,常温下为淡黄色透明液体,其晶体类型为____
②N和O位于同一周期,O的第二电离能大于N的第二电离能的原因是_____;
③NH4Cl中存在的作用力有_____,NH4Cl熔沸点高于CH3CH2OH的原因是_____,Ti(OCH2CH3)4分子中C原子的杂化形式均为 ____。
(3)钛酸锶(SrTiO3)可作电子陶瓷材料和人造宝石,其中一种晶胞结构如图所示。若Ti位于顶点位置,O位于____位置;已知晶胞参数为a nm,Ti位于O所形成的正八面体的体心,则该八面体的边长为_____ m(列出表达式)。
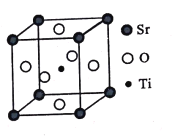
【答案】1s22s22p63s23p63d54s1 分子晶体 O和N分别失去一个电子后的价电子排布式1s22s22p3和1s22s22p2,前者是半充满结构,比后者稳定,所以第二电离能,前者大于后者 配位键、离子键、共价键 前者为离子晶体,后者为分子晶体(或离子键强于分子间作用力),离子晶体的熔沸点高于分子晶体的熔沸点 sp3杂化 棱心 ![]() a×10-9
a×10-9
【解析】
(1)根据核外电子的排布规则写出铬的核外电子排布式,注意3d轨道为半充满状态;
(2)①可溶于有机溶剂,根据相似相容原理,判断晶体的类型;
②写出N和O价电子排布式,然后分析;
③从氯化铵的电子式,判断化学键的类型;从晶体的类型不同判断熔沸点差异的原因;Ti(OCH2CH3)4分子中C原子的成键数目判断杂化方式;
(3)从晶胞的内部结构,根据Ti的位置,判断氧的位置;根据Ti和O的距离,计算八面体的边长。
(1)Cr原子是24号元素,核外电子排布式为1s22s22p63s23p63d54s1;
(2) ① Ti(OCH2CH3)4可溶于有机溶剂,有机溶剂大多数都是分子晶体,根据相似相溶,Ti(OCH2CH3)4是分子晶体;
②O和N分别失去一个电子后的价电子排布式2s22p3和2s22p2,前者是半充满结构,比后者稳定,所以第二电离能,前者大于后者;
③根据氯化铵的电子式: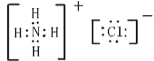 ,可以看出氯化铵中的化学键有铵根离子和氯离子间的离子键,氮原子和氢原子间共价键,氮原子与三个氢原子形成三对共价键,剩余一对电子与氢原子形成一对配位键,所以氯化铵中存在的作用力有离子键,共价键,配位键;
,可以看出氯化铵中的化学键有铵根离子和氯离子间的离子键,氮原子和氢原子间共价键,氮原子与三个氢原子形成三对共价键,剩余一对电子与氢原子形成一对配位键,所以氯化铵中存在的作用力有离子键,共价键,配位键;
Ti(OCH2CH3)4分子中C均形成四对σ键,故杂化方式为sp3杂化;
(3)从图中可以看出,若Ti位于顶点位置,则O可以看成位于棱心的中心位置;
Ti位于O所形成的正八面体的体心,八面体中Ti和O构成了一个等腰直角三角形,直角边长为![]() a,斜边长为
a,斜边长为![]() =
=![]() anm=
anm=![]() a×10-9m。
a×10-9m。