题目内容
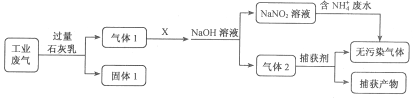
【题目】常温下,用 AgNO3 溶液分别滴定浓度均为 0.01 mol/L 的KCl、K2C2O4 溶液,所得的沉淀溶解平衡图像如图所示(不考虑 C2O42-的水解)。已知 Ksp(AgCl) 数量级为 10-10。下列叙述正确的是
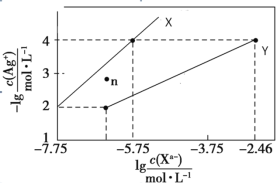
A.图中 Y 线代表的 AgCl
B.n 点表示 Ag2C2O4 的过饱和溶液
C.向 c(Cl-)=c(C2O42-)的混合液中滴入 AgNO3溶液时,先生成 AgCl 沉淀
D.Ag2C2O4+2Cl-=2AgCl+C2O42-的平衡常数为 10-0.71
【答案】C
【解析】
若曲线X为AgCl的沉淀溶解平衡曲线,则Ksp(AgCl)=c(Ag+)c(Cl)=104×105.75=109.75=100.25×1010,则数量级为10-10,若曲线Y为AgCl的沉淀溶解平衡曲线,则Ksp(AgCl)=c(Ag+)c(Cl)=104×102.46=106.46=100.54×107,则数量级为10-7,又已知Ksp(AgCl)数量级为 10-10,则曲线X为AgCl的沉淀溶解平衡曲线,则曲线Y为Ag2C2O4的沉淀溶解平衡曲线,Ksp(Ag2C2O4)=c2(Ag+)c(C2O42-)=(104)2×(102.46)=1010.46,据此分析解答。
若曲线X为AgCl的沉淀溶解平衡曲线,则Ksp(AgCl)=c(Ag+)c(Cl)=104×105.75=109.75=100.25×1010,则数量级为10-10,若曲线Y为AgCl的沉淀溶解平衡曲线,则Ksp(AgCl)=c(Ag+)c(Cl)=104×102.46=106.46=100.54×107,则数量级为10-7,又已知Ksp(AgCl)数量级为 10-10,则曲线X为AgCl的沉淀溶解平衡曲线,则曲线Y为Ag2C2O4的沉淀溶解平衡曲线,Ksp(Ag2C2O4)=c2(Ag+)c(C2O42-)=(104)2×(102.46)=1010.46,
A. 由以上分析知,图中X线代表AgCl,故A错误;
B. 曲线Y为Ag2C2O4的沉淀溶解平衡曲线,在n点,c(Ag+)小于平衡浓度,故n点的离子Qc(Ag2C2O4)<Ksp(Ag2C2O4),故为Ag2C2O4的不饱和溶液,故B错误;
C. 根据图象可知,当阴离子浓度相同时,生成AgCl沉淀所需的c(Ag+)小于生成Ag2C2O4沉淀所需的c(Ag+),故向c(Cl)=c(C2O42-)的混合液中滴入AgNO3溶液时,先析出氯化银沉淀,故C正确;
D. Ag2C2O4+2Cl-=2AgCl+C2O42-的平衡常数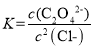 ,此时溶液中的c(Ag+)相同,故有
,此时溶液中的c(Ag+)相同,故有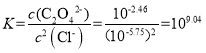 ,故D错误;
,故D错误;
故选C。

【题目】下列离子方程式的书写及评价,均合理的是
选项 | 离子方程式 | 评价 |
A | 用铜电极电解饱和KCl溶液:2H2O+2Cl- | 正确:Cl-的失电子能力比OH-强 |
B | 向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+ | 错误:H2S的酸性比H2SO4弱 |
C | Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3- +OH- ═BaCO3↓+H2O | 错误:Ba2+与HCO3-系数比应为1:2 |
D | 过量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3- | 正确:H2SO3的酸性比HClO强 |
A.AB.BC.CD.D