题目内容
【题目】现有NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现氯离子(Cl-)、硫酸根离子(SO42-)和硝酸根离子(NO3-)的相互分离,实验过程如下:
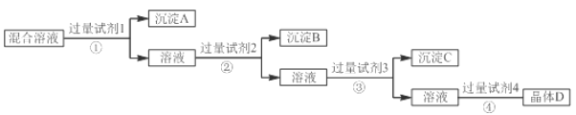
试剂3:Na2CO3;试剂4:硝酸
请回答下列问题:
(1)写出试剂②的名称______________。
(2)写出过量Na2CO3的目的是___________________________________________________。
(3)写出混合溶液D与过量硝酸反应的化学方程式:________________________________。
(4)写出操作④的名称______________。
【答案】硝酸银溶液 除去过量的Ba2+和Ag+ Na2CO3+2HNO3=2NaNO3+H2O+CO2 ![]() 蒸发
蒸发
【解析】
NaCl、Na2SO4和NaNO3的混合溶液,试剂①为氯化钡溶液(或硝酸钡溶液),生成沉淀A为硫酸钡,所得溶液中含有氯化钠和硝酸钠;加入试剂②为硝酸银溶液,反应生成沉淀B为氯化银,所得溶液中含有硝酸钠,以及过量的Ba2+、Ag+;加入过量试剂③Na2CO3以除去Ba2+、Ag+;最后加入足量稀硝酸酸化,蒸发结晶得到硝酸钠晶体。
(1)上述实验过程中所用试剂的名称:先分离出SO42-,试剂①为氯化钡溶液(或硝酸钡溶液),再分离出Cl-,试剂②为硝酸银溶液;
(2)加入过量Na2CO3的目的是除去溶液中过量的Ba2+、Ag+;
(3) 混合溶液D主要含有过量碳酸钠,与过量硝酸反应生成硝酸钠、二氧化碳和水,反应的化学方程式为:Na2CO3+2HNO3=2NaNO3+H2O+CO2 ![]() ;
;
(4)由溶液加过量稀硝酸后进行操作④得到硝酸钠晶体,故操作④的名称应为蒸发。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案【题目】硝基苯甲酸乙酯在OH-存在下发生水解反应:O2NC6H4COOC2H5+OH-O2NC6H4COOO-+C2H5OH两种反应物的初始浓度均为0.050mol/L,在不同温度下测得O2NC6H4COOC2H5的浓度(mol/L)随时间变化的数据如下表所示。下列有关说法不正确的是( )
t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
15℃ | 0.500 | 0.335 | 0.291 | 0.256 | 0.210 | 0.155 | 0.148 | 0.145 | 0.145 |
35℃ | 0.500 | 0.325 | 0.2775 | 0.238 | 0.190 | … | 0.135 | 0.135 | 0.135 |
A. 该反应在![]() ,120180s区间内O2NC6H4COOC2H5平均反应速率为7.33×10 -4 mol·L-1·s-1
,120180s区间内O2NC6H4COOC2H5平均反应速率为7.33×10 -4 mol·L-1·s-1
B. 由数据可知,随着反应的进行,反应物的浓度降低,反应速率减慢
C. 530s时,表格中35℃对应的数据一定是0.135
D. 由数据可知,温度升高反应速率加快
【题目】下列离子方程式的书写及评价,均合理的是
选项 | 离子方程式 | 评价 |
A | 用铜电极电解饱和KCl溶液:2H2O+2Cl- | 正确:Cl-的失电子能力比OH-强 |
B | 向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+ | 错误:H2S的酸性比H2SO4弱 |
C | Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3- +OH- ═BaCO3↓+H2O | 错误:Ba2+与HCO3-系数比应为1:2 |
D | 过量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3- | 正确:H2SO3的酸性比HClO强 |
A.AB.BC.CD.D
【题目】由下列实验及现象不能推出相应结论的是( )
实验 | 现象 | 结论 | |
A | 向 | 黄色逐渐消失,加 | 还原性: |
B | 将金属钠在燃烧匙中点燃,迅速伸入集满 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 |
|
C | 向某溶液中先加入氯水,再加入 | 加入 | 最初溶液中含有 |
D | 向2支盛有 | 两只试管中固体均溶解 | 氧化铝是两性氧化物 |
A. AB. BC. CD. D